Сеть «Хеликс» попала в список лучших лабораторий
Лабораторная служба «Хеликс» стала первой сетью лабораторий в СНГ, получившей аккредитацию Коллегии американских патологов (CAP). Таким образом компания получила международный сертификат стандартов качества лабораторной диагностики и была включена в список лучших лабораторий мира.
ДЛЯ СПРАВКИ: CAP — лидирующее международное сообщество практикующих сертифицированных патологов, которое поощряет и пропагандирует использование лучших практик лабораторной медицины по всему миру в течение уже более 70 лет. За это время сформировано почти 3000 требований к выполнению стандартов лабораторной диагностики. Они дополняются и обновляются ежегодно при участии более 500 экспертов. При этом требования СAP превышают требования ключевого отраслевого стандарта, принятого для медицинских лабораторий, ISO 15189.
Аккредитация CAP помогает лабораториям гарантировать достоверность результатов анализов и, как следствие, обеспечивать точный диагноз для пациента, говорят представители
Подготовка к получению аккредитации заняла у компании более двух лет и завершилась трехдневным аудитом московского лабораторного комплекса независимыми экспертами CAP. В рамках аудита отделения сети еженедельно получали «слепые» образцы биоматериала для проведения аналитики. В подавляющем большинстве случаев при исследовании «слепых» образцов лаборатории были не известны пол, возраст и анамнез пациента.
Помимо процесса исследований тщательным проверкам подверглись складские площади компании, где хранятся реагенты; также была оценена квалификация персонала, участвующего в выполнении исследований, и системы безопасности и охраны труда. Не остались без внимания и IT-алгоритмы валидации результатов лабораторных исследований.
«Одно из ключевых требований CAP — аккредитация лабораторного комплекса полностью, а не какой-то его части или группы исследований», — отмечает Ирина Ивановна Скибо, директор по технологиям и проектной работе «Хеликс».
На сегодняшний день бренд «Хеликс» присутствует в 130 городах России. По вывеской сети открыто более 350 диагностических центров и лабораторных пунктов, 330 из них работают по франшизе.
Экскурсия в лабораторию Helix — Я не боюсь идти по дороге — LiveJournal
. Но для того, чтобы туда попасть, нужно было внести особую дань — свою собственную кровь! Или, выражаясь, современным языком, нужно было сдать анализ крови, чтобы потом пойти в лабораторию и самим провести исследование.
Пока я направлялась в Хеликс на Карповке, моё сознание рисовало страшные картины, навеянные детскими воспоминаниями: медсестра с размаха всаживает в твой ни в чем не повинный палец иглу, на пальце выступает капля крови, но течь совсем не хочет, всё та же медсестра с садистскими усилиями начинает выжимать палец подобно белью после стирки, а потом усердно размазывать твою алую кровь по стёклышку. О, а иногда она ещё брала специальную грушу и выкачивала кровь с её помощью. ..
..
Руки как назло замёрзли даже в перчатках и предательски посинели. И как раз накануне в книжке «Год в Провансе» я читала про то, как одному фермеру не могли проткнуть палец и долго тыкали в него иголкой. В общем, я была готова ко всему.
Следующий этап, этап исследования, я представляла себе в других красках — как мы все будем смотреть в микроскоп на свои кровяные тельца, развозюкивать кровь всё по тому же стёклышку и прочие лабораторные подробности.
Справка: Лабораторная служба Хеликс работает в сфере лабораторной диагностики с 1998 года. В настоящее время является одним из лидеров лабораторной диагностики в России. Под брендом Хеликс открыто более 170 Диагностических центров и Лабораторных пунктов по всей стране. Лабораторная служба Хеликс выполняет анализы для более чем 750 частных и более чем 150 государственных медицинских учреждений, оказывает услуги клиентам в 96 городах России, имеет 3 технологических площадки площадью более 4 000 кв. м. в Москве, Санкт-Петербурге и Екатеринбурге.
3
Сначала нужно было заполнить документы, выбрать вид анализа (общий клинический или на холестерин) и уже только потом отправиться в кабинет.
Тут мои страшные ожидания не оправдались — кровь берут из вены, а это, как известно, вообще не доставляет никаких дискомфортных ощущений, в отличие от издевательств над пальцем.
Тут же даже висит информация обо всех плюсах:
4
Когда все сдали кровь и получили за это гематоген, пришёл курьер. Он забирает биоматериал (именно так это называется) и несёт его в лабораторию. Мы двигаемся за ним — для того, чтобы оказаться в лаборатории, нужно пересечь двор.
5
6
Женя nau_spb тут же раздобыл кота:
7
Тут уже нас поджидают наши биоматериалы:
8
Кровь благородного алого цвета.
Маркировка «cito» означает, что наши анализы — срочные.
9
Срочные анализы в Хеликсе делаются три часа. Как только всё готово, на телефон приходит смс, на электронную почту — результаты.
Эта лаборатория Хеликса одна в Петербурге, всё остальное — это пункты приёма биоматериала. Поэтому если вам нужно срочно и быстро, надо идти сюда, на набережную Карповки, 5.
В лабораторию везут анализы не только из других районов Петербурга, ну и из других городов. Даже из Владивостока!
Почему?
Во-первых, лаборатория прекрасно оснащена и таких качественных у нас немного.
Во-вторых, это бывает быстрее, проще и дешевле, чем делать на местах.
Всего лабораторий у Хеликса три — в Петербурге, в Москве и в Екатеринбурге.
10
Есть ли вообще у Хеликса конкуренты в сфере лабораторных исследований?
Есть компания Инвитро, но, как оказалось, некоторые анализы они отдают друг другу на аутсорс. Так что всё соперничество очень условно, главное — результат.
11
12
Хранилище биоматериала. Кровь после выдачи результата неделю хранится в лаборатории. Другие биоматерилы — один день. Так что если вдруг что-то не так, всегда можно успеть перепроверить.
13
Экскурсию нам провела Ирина Ивановна Скибо, директор технологического департамента Лабораторной службы Хеликс.
Тот человек, который знает о лаборатории всё и тот, чья подпись стоит на всех результатах анализов.
14
15
16
А тут наша кровь продолжает путь. Первое, что с ней происходит — процесс маркировки пробирок. Тут считывается информация с qr-кода, клеится штрихкод. Он должен быть наклеен ровно и в правильном месте, чтобы все приборы его правильно считывали.
Нам тут же предложили в этом поучаствовать. Согласилась всего пара человек. «Ну вот, а говорили, что крови не боитесь!» — подтрунивали над нами сотрудники.
А я что, я не боюсь, я всё жду микроскопа.
17
18
Бактериологическую лабораторию проходим мимо и смотрим из-за стекла:
19
Нас так строго предупредили, чтобы мы не мешали людям работать, что я боялась хоть как-то потревожить сотрудников. Здесь они работают круглосуточно — 3 смены по 8 часов.
20
Путешествия нашей крови продолжаются=)
На этом этапе я уже начала понимать — никаких микроскопов и возни с пробирками мне не светит. Тут всё полностью автоматизировано!
Всё делают машины, а люди контролируют все процессы.
Например, есть специальный аппарат, который сам забирает кровь из пробирки, прокалывая крышку и размазывает их по стёклышку.
Это полностью автоматизированная система для приготовления и окраски мазков крови. Использование интеллектуального клинового метода дает возможность регулировать объем наносимого образца крови, величину угла размазывающего лезвия, скорость нанесения и время ожидания, благодаря чему получаются стандартизованные препараты для дальнейшего анализа. Штрихкодовая и цифровая маркировка, автоматически наносимая на слайд, исключает случайные ошибки.
21
Тут всё такое красивое и все такие красивые!
22
23
Кто-то спросил, а что будет, если пробирка, например, упадёт и разобьётся?
Так вот ответ — даже если она упадёт, то не разобьётся, так как сделана из пластика, а не из стекла. Крышка тоже не отлетит, надета она плотно и в процессе исследования не снимается — автомат лишь её прокалывает и берёт нужное количество крови.
Крышка тоже не отлетит, надета она плотно и в процессе исследования не снимается — автомат лишь её прокалывает и берёт нужное количество крови.
24
25
26
Это небольшой шейкер — постоянно взбалтывает кровь:
27
После прогона крови на автомате, идет сортировка: что-то в выдачу, что-то в микроскопию.
Микроскопия — анализы попадают к врачу, который внимательно изучает их на компьютере
28
Никогда ещё анализы не были такими красивыми.
29
30
А вот и компьютер.
Раньше, говорят, все эти клеточки и состав крови считали вручную! А сейчас всё посчитает компьютер
31
Вожделенный микроскоп тут всё же есть. Если врачу будет необходимо проверить результаты, он будет в него смотреть:
32
33
Это полностью автоматические преаналитические системы, предназначенные для автоматизации лабораторных процессов. Позволяют управлять потоками образцов, обеспечивая их прослеживаемость в процессе проведения исследований. Данные машины выполняют функции сортировки, аликвотирования, открывания пробирок, а также их архивирования после завершения исследований.
Данные машины выполняют функции сортировки, аликвотирования, открывания пробирок, а также их архивирования после завершения исследований.
34
Автомат так же запечатывает пробирки после проведения всех исследований и в уже в таком виде они отправляют на хранение:
35
36
37
38
39
А это автоматический диагностический прибор, используемый для диагностики аллергических и аутоиммунных заболеваний.
Благодаря уникальной технологии ImmunoCAP обнаруживает сверхнизкие концентрации IgE-антител и других показателей в малом количестве крови. На сегодняшний день это наиболее точная технология лабораторной диагностики аллергий. Используется в большинстве крупных диагностических лабораторий Европы и Северной Америки.
40
Если у человека аллергия на что-то, то этот прибор помогает обнаружить конкретный продукт, а не просто группу продуктов
41
42
А после мы отправились ужинать в грузинский ресторан и ждать результатов (ведь анализы нужно сдавать на голодный желудок и пора уже было подкрепиться). С тех пор мне постоянно хочется оджахури. Вот такая история.
С тех пор мне постоянно хочется оджахури. Вот такая история.
Спасибо за компанию nau_spb, swoofe, svetty, 2dar, dimkagrigoryev, alder, michaelmilaev, digestlj, itditpspb.
И нашим прекрасным экскурсоводам, а так же очаровательной Юлии Конаковой, как могло не понравиться в Хеликсе, когда у тебя такие проводники? Кадры решают всё!
Медицинский центр «Земский врач» » Архив блога » Наш выбор сделан. Это лаборатория Хеликс.
Друзья!
Мир вокруг меняется. И вслед за ним мы тоже не стоим на месте.
Мы стремимся стать лучше — лицензируем новые направления, приглашаем лучших врачей-специалистов, выбираем лучшие лаборатории.
Главная наша цель — высокое качество предоставляемых медицинских услуг.
Значительное количество исследований проведенных для наших Пациентов, позволяет нам выделить наилучшую лабораторию для продолжения сотрудничества.
Наш выбор сделан. Это лаборатория Хеликс.
Лабораторная служба Хеликс — динамично развивающаяся лаборатория, с высочайшим уровнем оснащения, логистики и качества управления.
Хеликс — доступная стоимость при высочайшем качестве выполняемых тестов, а отсутствие переплат — это забота о наших Пациентах.
P.S. по Гемотесту, или почему мы прекратили сотрудничество.
- На самом деле первые звоночки прозвенели уже прошлым летом, когда Гемотест массово стали покидать ключевые ТОП-менеджеры, обеспечившие взрывной рост компании в последние годы. Не все из них были согласны с начавшейся политикой агрессивной монетизации. Уход профессионалов не мог не отразиться на качестве работы.
- Даже мы в Волоколамске почувствовали изменения в работе.
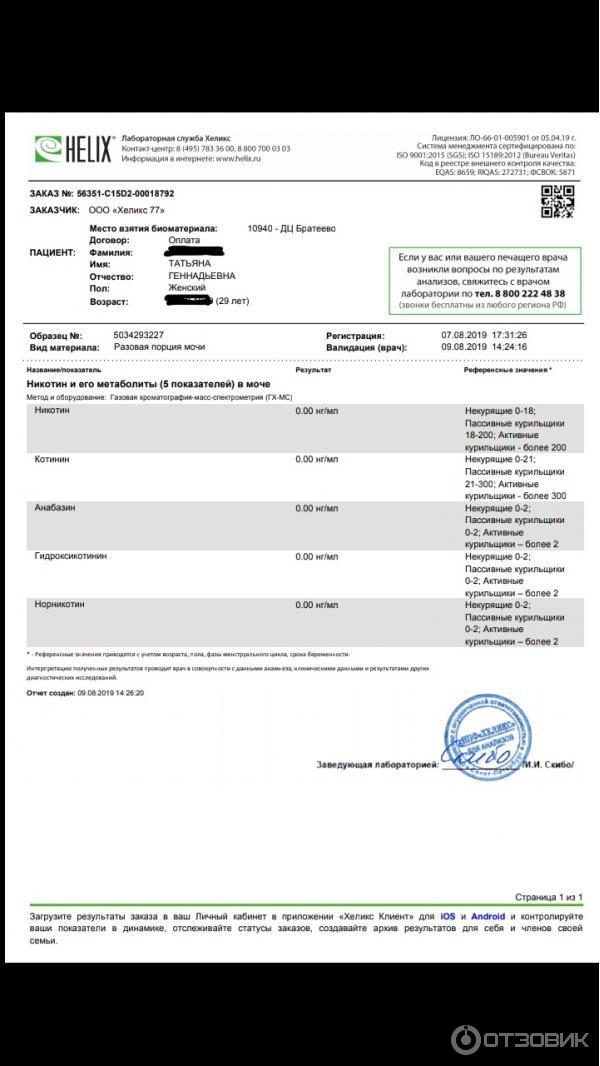
 4 МЕ/мл. Она этот анализ сдавала как в Хеликсе, так и во многих других клиниках уже многие и многие годы.
4 МЕ/мл. Она этот анализ сдавала как в Хеликсе, так и во многих других клиниках уже многие и многие годы.Последний раз сдаем анализ в Хеликсе, получаем результат «менее 75 МЕ/мл». В чудеса мы не верим, поэтому приходим в лабораторию и объясняем, что произошла ошибка. Предоставили результаты за последние 3 года, большая часть которых сделана у них же в Хеликсе. Нас посылают со словами «мы ничего сделать не можем, анализы сделаны правильно». Хорошо, звоним и пишем на e-mail поддержки. Нам сначала «впаривают», что у них поменялась методика выполнения анализа. Но никакое изменение методики не может объяснить изменение результата в 200 (двести!) раз. Потом они якобы передают нашу претензию в группу по контролю качества, которая, понятное дело, «начинает расследование» в результате которого «никаких нарушений не выявлено». Лохотрон, одним словом.
Вывод: почти 3000 р потрачены в пустую. С таким же успехом можно было буквально выкинуть на ветер 3 купюры по 1000р и написать себе на бумажке в качестве результата любое число, которое вам больше нравится Smile
Еще более страшно то, что ты совершенно не знаешь, какой же у тебя на самом деле результат анализа, т.
 к. в Хеликсе — совершенно случайные числа никак не связанные с реальностью. Сдал анализ, вроде все в норме, а на самом деле, далеко не в норме.
к. в Хеликсе — совершенно случайные числа никак не связанные с реальностью. Сдал анализ, вроде все в норме, а на самом деле, далеко не в норме.P.S. Пересдали анализ в Инвитро — как и ожидалось, результат долек от «менее 75 МЕ/мл». Кормить Хеликс за совершенно случайные числа больше не собираемся. Делайте выводы сами.
Власти Москвы массово проводят тесты на антитела к коронавирусу. Зачем?
- Олег Болдырев
- Би-би-си
Автор фото, Sergei Fadeichev/TASS
Власти Москвы проводят массовое тестирование москвичей на антитела к новому коронавирусу. О программе забора образцов крови сообщил на прошлой неделе мэр Сергей Собянин: по его словам, каждую неделю в 30 поликлиниках столицы будут собираться до 70 тысяч анализов.
Конкретные последствия этого тестирования остаются туманными, но судя по обнаруженному документу, тем, у кого антитела найдутся, грозит самоизоляция.
 Как это сочетается с заявлениями мэра Собянина о том, что антитела свидетельствуют об иммунитете — непонятно.
Как это сочетается с заявлениями мэра Собянина о том, что антитела свидетельствуют об иммунитете — непонятно.Би-би-си попыталась выяснить, какую пользу может дать эта программа, и чьи тесты используются.
Что московские власти надеются выяснить?
Ответим словами московского мэра Сергея Собянина: «Мы будем точно знать, какая доля москвичей переболела коронавирусом и приобрела иммунитет, сколько человек инфицированы или имеют подозрение на коронавирус. И главное — какова реальная динамика распространения инфекции».
Рассказывая о начале программы на сайте mos.ru, столичный мэр подчеркивает, что тест на антитела дополнит картину, которую давали тесты собственно на ковид, которые собирали у тех, чьи симптомы проявлялись открыто. И он неоднократно употребляет слово «иммунитет».
Между тем вот именно с иммунитетом к новому коронавирусу все еще совсем далеко от ясности. И тесты на антитела эту ясность пока внести не могут.

Что такое антитела? Если их нашли у меня, значит я больна?
Антитела — свидетельство того, что ваш организм уже сталкивался с инфекцией. Как и почти со всем, что связано с новым коронавирусом, сейчас нельзя сказать точно, какую именно роль играли антитела в общем ответе организма на Covid-19. Являлись ли они просто реакцией на встречу с вирусом или же имеют защитную функцию — неизвестно.
Но, анализируя тест, обращают внимание на присутствие иммуноглобулинов двух типов — IgM и IgG. Упрощая, можно сказать, что присутствие IgM говорит о том, что инфекция была перенесена недавно, IgG — о том, что со времени заражения уже прошло какое-то время.
Вот как эту разницу объясняет Михаил Фаворов, эпидемиолог и президент американской компании DiaPrep System: наличие маркера IgG говорит о том, что был контакт с вирусом. А IgМ является маркером периода болезни. «Если у Вас оба маркера (IgG, IgМ), то вы переболели (большинство без симптомов), и это было недавно (1-3 месяца, но у некоторых до 6-ти).
 Если у вас только IgG, то Вы уже реконвалесцент (выздоровевший — ред.) и могли встретиться с вирусом какое-то время назад», — пишет Фаворов.
Если у вас только IgG, то Вы уже реконвалесцент (выздоровевший — ред.) и могли встретиться с вирусом какое-то время назад», — пишет Фаворов.Что ждет тех, у кого скрининг выявит антитела?
В заявлении мэра говорится и о том, что «потенциальные носители инфекции должны будут брать больничный и проходить самоизоляцию». Как конкретно это будет определяться, не говорилось. Но некоторую ясность внес документ, появившийся на сайте «Федерации лабораторной медицины». Это — решение «Клинического комитета по Covid-19» от 12 мая.
Судя по решению «Клинического комитета», власти нервирует любое обнаружение антител. Как тех, что свидетельствуют о недавно перенесенной болезни, так и тех, что относятся к сравнительно давнему иммунному ответу.
В решении «Клинического комитета» содержится таблица интерпретации диагностических тестов. Данные по маркерам IgM равные или больше 1,0 и IgG с любым значением будут говорить о «стадии иммунологического ответа на вирус SARS-CoV-2».
 И могут повлечь за собой самоизоляцию на две недели, а «с учетом особенностей клинического процесса до 3 недель». Показатели IgM меньше 1,0 и IgG равных или больше 10,0 означают «наличие иммунологической памяти на контакт с вирусом SARS-CoV-2» и, если нет информации о ранее перенесенной новой коронавирусной инфекции, тоже могут означать самоизоляцию на 2 недели.
И могут повлечь за собой самоизоляцию на две недели, а «с учетом особенностей клинического процесса до 3 недель». Показатели IgM меньше 1,0 и IgG равных или больше 10,0 означают «наличие иммунологической памяти на контакт с вирусом SARS-CoV-2» и, если нет информации о ранее перенесенной новой коронавирусной инфекции, тоже могут означать самоизоляцию на 2 недели.И лишь только низкие показатели (IgM меньше 1,0 IgG меньше 10,0 ) говорят об «отсутствии контакта с вирусом SARS-CoV-2 или отсутствии антител в диагностически значимом количестве». Тем у кого такие результаты, рекомендовано «соблюдение общих правил по предотвращению инфицирования».
Би-би-си попыталась связаться с президентом «Федерации лабораторной медицины», руководителем отдела лабораторной диагностики института им. Склифосовского Михаилом Годковым, который значился одним из участников совещания 12 мая. Годков был недоступен, а вскоре документ исчез с сайта Федерации.
Вскоре после публикации этой статьи департамент здравоохранения Москвы заявил, что никаких мер, о которых повествует таблица интерпретации диагностических тестов, не существует.
 «Информация не соответствует действительности. Якобы утвержденных алгоритмов, о которых говорится в материалах, не существует. Пациентам, у которых выявлены иммуноглобулины G, говорящие об иммунитете к вирусу, никакие постановления или предписания о самоизоляции не выдаются», — утверждает департамент.
«Информация не соответствует действительности. Якобы утвержденных алгоритмов, о которых говорится в материалах, не существует. Пациентам, у которых выявлены иммуноглобулины G, говорящие об иммунитете к вирусу, никакие постановления или предписания о самоизоляции не выдаются», — утверждает департамент.Просьбы Би-би-си уточнить происхождение документа и суть принятых решений, направленные в депздрав перед публикацией статьи, пока ожидают ответа. Интересно, что слово «алгоритм» не использовано в этой статье, но содержится как раз в упомянутом решении.
Так я не понял. Если у меня нашли антитела, то я уже не заболею ковидом?
Вопрос, что называется, на миллиард долларов, если учесть экономические потери от пандемии. Но ответить на него однозначно пока никто не может. «Есть антитела просто как свидетель того, что контакт с инфекцией был, но они не обладают нейтрализующей активностью», — подчеркивает автор одного из зарегистрированных недавно тестов на антитела, российский ученый Григорий Ефимов из НМИЦ гематологии минздрава РФ.

Специалисты предполагают (однако и это не 100-процентная уверенность), что наличие достаточной концентрации антител в первые недели после выздоровления существенно уменьшает шансы на повторное заражение. Однако как долго они сохраняют защитную функцию, неизвестно. «В настоящий момент нет никаких свидетельств того, что люди, которые выздоровели от Covid-19 и имеют антитела, защищены от повторного инфицирования», — заявила Всемирная организация здравоохранения.
В исследованиях пациентов, переболевших другой коронавирусной инфекцией, атипичной пневмонией SARS 2003 года, отмечалось, что с годами антитела к вирусу исчезали и организм переставал узнавать его. Есть и другие коронавирусы, иммунитета к которым наш организм не приобретает.
Ой. Еще коронавирусы? А тесты хорошо отличают одни от других?
С учетом нового 2019-nCoV, коронавирусов, способных заразить человека, сейчас известно семь. Взять хотя бы банальную простуду — ее тоже могут вызывать коронавирусы, только других видов.

Часть проблемы с тестированием — в том, что иммунный ответ на прочие коронавирусы и на другие инфекции может давать ложное указание на наличие антител к 2019-nCoV, снижая, таким образом, специфичность теста. Эти ложные срабатывания на другие следы завышают показатель ложно-положительности в тесте.
Его недостаточная чувствительность, напротив, упускает тех, кто действительно носит в себе следы инфицирования новым коронавирусом. А значит, будет много ложно-отрицательных. В идеальном тесте не должно быть ложно-положительных или ложно-отрицательных срабатываний.
Но идеальных тестов нет. А что считать хорошим тестом?
Уже через несколько недель после начала пандемии в разных странах стали появляться тесты на антитела к новому вирусу. И специфичность, и точность многих из них не выдерживали критики. Опрошенные специалисты сходятся в том, что показатели чувствительности и специфичности ниже 96-94% нельзя считать приемлемыми.

Проблема еще и в том, что многие производители не указывают отдельных показателей по ложно-положительным и ложно-отрицательным срабатываниям в своей продукции. Да к тому же рекламируемая точность отнюдь не всегда является реальной. Но даже если точность и не дотягивает всего три-четыре процента до абсолютной, простор для ошибки статистически весьма велик, подчеркивают те, кто скептически относятся к идее массового тестирования на антитела.
95 из 100? Какой может быть скепсис?
Спросите математиков. Объяснение упирается в концепцию Положительной прогностической ценности (Positive Prediction Value): в огромной группе исследуемых с низким количеством реально переболевших (предполагают, что это все-таки считаные проценты от общего числа жителей) даже небольшие доли погрешности в тестах в итоге очень сильно размывают определенность результата.
В условной группе из 100 тысяч тестируемых с 1% переболевших тест с 95-процентными показателями чувствительности и специфичности приведет к тому, что вероятность верного результата у каждого протестированного сведется всего к 16%.
 Специалисты подчеркивают, что такой тест точно нельзя делать тем, кто, скажем, отправляется работать в «красную зону», надеясь, что выявленные антитела к коронавирусу гарантируют им защиту.
Специалисты подчеркивают, что такой тест точно нельзя делать тем, кто, скажем, отправляется работать в «красную зону», надеясь, что выявленные антитела к коронавирусу гарантируют им защиту.Проблема в том, что для таких критических расчетов хорошо бы представлять процент переболевших. А московские власти говорят, что не представляют. И поэтому делают это массовое обследование, так как другого способа выяснить нет. Круг замыкается.
Хватит теории. Чем тестируют москвичей в этом скрининге?
Еще один хороший вопрос без четкого ответа. Несколько опрошенных специалистов в Москве уверены, что речь идет о двух тестах китайской компании Shenzhen Mindray Bio-Medical Electronics Co., Ltd., продукцию которой в России представляет компания «Миндрей медикал рус». Об этом свидетельствует и «Решение клинического комитета». Документ говорит «о запуске тестирования на количественное определение IgM- и IgG-антител к SARS-CoV-2 методом ИХЛА (иммунохемилюминисцентного анализа — ред.
 ) с использованием оборудования Mindray».
) с использованием оборудования Mindray».Две ее системы для определения антител по маркерам IgM и IgG методом иммунохемилюминисцентного анализа были зарегистрированы Росздравнадзором 7 мая. Кроме этого должны были быть закуплены анализаторы крови этой же компании. О закупке анализаторов для скрининга московские власти сообщали в начале мая. Однако поставщиков не называли.
Но специалисты указывают, что большинство других тест-систем не нуждаются в особом, за пределами стандартного, оборудовании для анализа, а тесты «Миндрей» собираются в кассеты, которые затем вставляются в анализатор этой фирмы. Правда, это предположение не согласуется с заявлением мэра Москвы, который сказал, что тестирование будет идти методом иммуноферментного анализа. Такой анализ обычно не требует каких-то необычных анализаторов для исследования взятых образцов крови.
Департамент здравоохранения столицы переадресовал вопросы о производителе тест-систем в московский оперативный штаб по борьбе с коронавирусом.
 На момент публикации ни оперштаб, ни «Миндрей медикал рус» не ответили на вопрос о том, действительно ли эти тесты обеспечивают массовую проверку москвичей. В системе госзакупок не удалось обнаружить никаких контрактов, связанных с этим.
На момент публикации ни оперштаб, ни «Миндрей медикал рус» не ответили на вопрос о том, действительно ли эти тесты обеспечивают массовую проверку москвичей. В системе госзакупок не удалось обнаружить никаких контрактов, связанных с этим.Хм. Ну, предположим «Миндрей». И как он?
Как говорится, все сложно. Показатели в англоязычной документации на оба теста дают чувствительность в 98% и специфичность в 96%. Но в появившихся в сети снимках русскоязычной сопроводительной брошюры показатели иные — 97% чувствительности и 93,1% — специфичности.
Екатерина Померанцева, научный консультант центра генно-репродуктивной медицины Genetico, только что зарегистрировавшего свой тест на антитела к коронавирусу, находит это странным. Она считает, что с какой-то погрешностью теста можно мириться, но для этого она должна быть точно известна. «Если ты очень хорошо знаешь, какая ошибка у системы, то ты можешь получить какую-то цифру (на исследованиях — ред.
 ), а потом просто вычесть эти четыре процента из полученного результата. Для этого важна твоя точность представлений об этом тесте. Поэтому очень большой вопрос, насколько точно мы знаем аналитические характеристики этого теста», — говорит она.
), а потом просто вычесть эти четыре процента из полученного результата. Для этого важна твоя точность представлений об этом тесте. Поэтому очень большой вопрос, насколько точно мы знаем аналитические характеристики этого теста», — говорит она.Запрос в представительство «Миндрей медикал рус» о том, с чем может быть связано это изменение и проходили ли тесты независимую оценку, на момент публикации остается без ответа. Такая независимая оценка сейчас в ходу.
Президент DiaPrep System Михаил Фаворов сообщил, что его компания недавно исследовала шесть экспресс-тестов на антитела к коронавирусу по заказу властей «одной из стран бывшего СССР». Три из них, по словам специалиста, полностью провалились — не смогли выявить антитела вообще. И это — несмотря на заявленные в документации высокие показатели, сравнимые с теми, что дает китайская компания.
О расхождениях между заявленными в документациях и реальными показателями некоторых изученных на заказ тестов сказала и Екатерина Померанцева из Genetico.

Если на самом деле точность теста ниже, то чем мы рискуем? И для чего это вообще?
Этот вопрос впрямую связан с тем, какие цели ставят московские власти. Во-первых, Сергей Собянин говорит о принятии «управленческих решений, связанных с планированием работы медицинской системы и сохранением либо смягчением действующих ограничений».
«Это необходимо, чтобы адекватно принимать решения, связанные с ограничительными мерами, работой предприятий сферы промышленности, строительства, науки, торговли, услуг и так далее, чтобы мы понимали, куда мы идем, на какой стадии сложности находимся, оперативно и адекватно принимали необходимые меры», — сказал он в одном из недавних интервью.
Би-би-си попросила московские власти пояснить, какие конкретно решения могут быть связаны с теми или иными численными показателями московского скрининга, но ответа пока не получила. Официальные заявления Сергея Собянина пока ничего не проясняют: до сих пор все решения по ослаблению карантина ставились в зависимость от уменьшения динамики заражений на ежедневной основе, а новые данные об уже перенесенных заболеваниях не сопоставляются с ними напрямую.

В любом случае, и тут Москва пока ведет себя более консервативно, чем другие регионы. Какие конкретно эпидемиологические выводы власти намерены сделать на основе массового скрининга, пока неясно. Речь точно не идет о каких-либо дополнительных послаблениях или расширенных свободах для тех, у кого антитела найдут, и никаких «паспортов переболевших» этот скрининг не подразумевает.
Скорее наоборот. Из «таблицы интерпретации результатов» следует, что ложно-положительные срабатывания теста будут означать неудобства для тех, кого ошибочно могут отправить на карантин. Правда, Собянин оговаривается, что таким людям будут сделаны стандартные ПЦР-тесты на коронавирус. Однако и их результатов, как показывают два месяца эпидемии, иногда надо ждать долго и они также не точны.
Собянин говорит, что Москва в таких тестах — впереди планеты всей. Это так?
Норвежец Хенрик Ярлов ведет открытый подсчет всех массовых тестирований на антитела к коронавирусу.
 Пока что в его базе данных из 74 экспериментов с тестированием упоминаний о московском нет, а самой массовой следует считать программу тестирования в Испании с упоминанием о 60 тысячах участников. Если Москва обеспечит хотя бы половину из заявленных 70 тысяч в неделю до конца мая, это исследование будет самым значительным по масштабу среди других.
Пока что в его базе данных из 74 экспериментов с тестированием упоминаний о московском нет, а самой массовой следует считать программу тестирования в Испании с упоминанием о 60 тысячах участников. Если Москва обеспечит хотя бы половину из заявленных 70 тысяч в неделю до конца мая, это исследование будет самым значительным по масштабу среди других.Данные о пропорции положительных результатов в закончившихся обследованиях варьируются чрезвычайно — в одном из экспериментов в Италии, как следует из данных сводной ведомости, у 50% обследованных были найдены антитела. Подавляющее большинство проведенных кампаний по тестированию показывают куда меньшее количество переболевших — от долей процента до 3-4%.
Однако объяснений и трактовок полученным результатам масса, и многие комментаторы говорят о неправильной методологии и сомнительном качестве самих тестов. Ясности пока очень мало. Гарантировать, что московский скрининг обогатит мировые знания о заболеваемости коронавирусом, никто пока не берется.

Каких-либо конкретных решений, которые бы проистекали из тестирования на антитела, ни в одной стране пока не принимали. Впрочем, власти в разных странах не исключают, что они могут помочь. В Великобритании замминистра здравоохранения заявил, что тесты могут стать поворотным моментом в борьбе с коронавирусом. Это произошло после того, как Public Health England — одно из исполнительных подразделений минздрава — одобрило к использованию тест на антитела производства компании Roche. Однако пока правительство не закупало этот тест для массового использования. Британские власти «обожглись» на закупке огромной партии экспресс-тестов на антитела, точность которых оказалась очень низкой.
В конце апреля тесты на антитела начались в двух городах Южной Кореи. Как и в России, представители системы здравоохранения заявили, что исследование поможет определить процент переболевших коронавирусом. Заявлено, что программу обследования на антитела, вероятно, распространят в масштабах всей страны, но о конкретных последствиях тоже пока не говорят.

Так все-таки надо обследовать огромные группы людей или пользы в этом нет?
Многие из исследований на антитела к коронавирусу за рубежом проводились на ограниченных социальных или профессиональных группах, иногда числом всего в несколько сотен человек. Претензии к одному из первых и широко обсуждавшихся исследований такого рода — тестированию 3300 жителей графства Санта-Клара в Калифорнии в апреле — сводились к критике выборки тестируемых и доли ложно-положительных результатов в использованном тесте.
При этом многие утверждают, что именно ограниченное тестирование в отдельных группах — скажем, среди врачей — может дать какую-то полезную пищу для размышлений. Автор одной из тест-систем, недавно зарегистрированных и используемых в коммерческой лаборатории, Григорий Ефимов из НМИЦ гематологии говорит, что для полноценных выводов не подходят, к примеру, данные коммерческих лабораторий.
«Там выборка не будет репрезентативной — пришли те люди, которые имеют основание думать, что они переболели, и это будет очень сильно искажать статистику.
 Для того, чтобы получать настоящую статистику, надо действительно брать случайных людей», — считает он. Ефимов не видит вреда в том, что, пусть и с какой-то вероятностью статистических ошибок, такое массовое тестирование состоится.
Для того, чтобы получать настоящую статистику, надо действительно брать случайных людей», — считает он. Ефимов не видит вреда в том, что, пусть и с какой-то вероятностью статистических ошибок, такое массовое тестирование состоится.Михаил Фаворов из DiaPrep System говорит, что системного подхода к тестированию на антитела нет. «Популяционные исследования иммунитета к респираторным вирусам — хорошо известная вещь. Они должны проводиться на основе выборки групп населения и методов научно обоснованной статистики. Но это должны делать специалисты аналитической эпидемиологии, которых в России не готовили даже в позднейший период, не говоря уж о временах СССР». Он подчеркивает необходимость создания национального органа по сертификации тестов на антитела, но говорит, что это вступит в противоречие с коммерческими и научными интересами тех, кто заинтересован в продвижении своих разработок.
В условиях беспрецедентной пандемии безусловную ценность московского скрининга на антитела отмечает вирусолог, доктор биологических наук Алексей Аграновский.
 «Это большие числа. Это все же дает картину того, сколько человек переболели в популяции. И другого способа получить ее не существует. Пускай даже и будет ошибка в три-четыре процента, я не считаю ее фатальной. Массовый скрининг даст возможность, принимая во внимание большую надежность иммунологического теста в сравнении с ПЦР (тот самый мазок у больных в активной фазе — ред.), установить реальный процент переболевших, эффективность принятых мер. Что нам ждать, насколько высока прослойка иммунной защиты в популяции. Эти данные можно получить только «в поле», их нельзя вычислить».
«Это большие числа. Это все же дает картину того, сколько человек переболели в популяции. И другого способа получить ее не существует. Пускай даже и будет ошибка в три-четыре процента, я не считаю ее фатальной. Массовый скрининг даст возможность, принимая во внимание большую надежность иммунологического теста в сравнении с ПЦР (тот самый мазок у больных в активной фазе — ред.), установить реальный процент переболевших, эффективность принятых мер. Что нам ждать, насколько высока прослойка иммунной защиты в популяции. Эти данные можно получить только «в поле», их нельзя вычислить».Но в скрининг я, по статистической вероятности, не попаду. А что у частных лабораторий, чьи тесты лучше?
В России зарегистрировано около 20 тестов на антитела к коронавирусу, как иностранных, так и российского производства. Их авторы и владельцы, естественно, подчеркивают надежность и точность своей технологии. К примеру, на совещании по генетическим исследованиям с президентом Путиным директор Института молекулярной биологии им.
 Энгельгардта академик Макаров заявил, что в глобальном исследовании тест-систем на антитела к коронавирусу «была и наша система. Хочу отметить, что она заняла хорошее место, первое-второе поделила».
Энгельгардта академик Макаров заявил, что в глобальном исследовании тест-систем на антитела к коронавирусу «была и наша система. Хочу отметить, что она заняла хорошее место, первое-второе поделила».Никаких ссылок на это исследование академик не привел, и понадобилось некоторое время, чтобы понять, что речь идет об антигенах, переданных из университета Маунт-Синай в США в Россию, на которых ИМБ теперь делает свои наработки.
Помимо бесплатного московского скрининга услуги по выявлению антител к коронавирусу предлагают несколько коммерческих лабораторий («Хеликс», Genetico, «Инвитро», «Гемотест», KDL, GMS Moscow, Hadassa). Не все из них указывают, чьи тесты используются.
Оплатив такой тест, вы сможете с какой-то вероятностью утверждать, что переболели новым коронавирусом. Гарантировать, что вы не заболеете им снова, сейчас не возьмется ни один из многих тысяч ученых, работающих по всему миру над разгадкой тайн 2019-nCoV.
При участии Николая Воронина и Светланы Рейтер
Об организации исследований на COVID-19 и изменении перечня контингентов, обследуемых в медицинских и коммерческих организациях Ямало-Ненецкого автономного округа на COVID-19 (с изменениями на 13 мая 2020 года), от 07 мая 2020 года №13
Об организации исследований на COVID-19 и изменении перечня контингентов, обследуемых в медицинских и коммерческих организациях Ямало-Ненецкого автономного округа на COVID-19
(в ред.
 постановления Главного государственного санитарного врача по ЯНАО от 13.05.2020 N 14)
постановления Главного государственного санитарного врача по ЯНАО от 13.05.2020 N 14)Я, Главный государственный санитарный врач по Ямало-Ненецкому автономному округу Л.А. Нечепуренко, проанализировав уровень организации лабораторной диагностики подлежащих обследованию контингентов на COVID-19 в регионе, отмечаю его достаточно высокое значение.
По состоянию на 7 мая 2020 г. в ПЦР-лабораториях округа проведено 54430 исследований, обследовано 50501 человек. Показатель тестирования на 100 тыс. населения составляет 9326 человек и остается одним из самых высоких в Российской Федерации.
По состоянию на 7 мая 2020 г. на территории автономного округа выявлено 1053 положительных тестов на новую коронавирусную инфекцию, за сутки 33 новых верифицированных положительных проб в ПЦР-лабораториях центров ФБУЗ «Центр гигиены и эпидемиологии в ЯНАО». В округе осуществляют деятельность 9 ПЦР-лабораторий на базе государственных учреждений здравоохранения Ямала и 4 лаборатории в системе учреждений Роспотребнадзора, кроме того, на коммерческой основе осуществляют деятельность две частных лаборатории в г. Новый Уренгой. Ежедневно в округе осуществляется тестирование в объеме от 1700 до 2100 исследований, отмечается высокий уровень верификации положительных (сомнительных) проб, 85% и более в течение 10 дней.
Новый Уренгой. Ежедневно в округе осуществляется тестирование в объеме от 1700 до 2100 исследований, отмечается высокий уровень верификации положительных (сомнительных) проб, 85% и более в течение 10 дней.
В лабораториях Ямала выполняются в полном объеме требования по обеспечению биологической безопасности в соответствии с имеющимися санитарно-эпидемиологическими заключениями.
В целях обеспечения санитарно-эпидемиологического благополучия на территории Ямало-Ненецкого автономного округа, для обеспечения лабораторного подтверждения COVID-19, в соответствии с Федеральным законом от 30.03.1999 N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения» (Собрание законодательства Российской Федерации, 1999, N 14, ст. 1650; 2002, 1 (ч. 1), ст. 2; 2003, N 2, ст. 167; N 27 (ч. I), ст. 2700; 2004, N 35, ст. 3607; 2005, 19, ст. 1752; 2006, 1, ст. 10; 52 (ч. 1) ст. 5498; 2007, N 1 (ч. 1) ст. 21, ст. 29; 27, ст. 3213; 46, ст. 5554; 49, ст. 6070; 2008, N 29 (ч. 1), ст. 3418; 30 (ч. П), ст. 3616; 2009, 1, ст. 17; 2010, N 40, ст. 4969; 2011, N 1, ст. 6, 30 (ч. 1), ст. 4563, ст. 4590, ст. 4591, ст. 4596; 24, ст. 3069; 26, ст. 3446; 2013, N 27, ст. 3477; 30 (ч. I), ст. 4079), санитарно-эпидемиологическими правилами СП 3.1./3.2. 3146-13 «Общие требования по профилактике инфекционных и паразитарных болезней», методическими рекомендациями МР3.1.0169-20 «Лабораторная диагностика COVID-19», изменения N 1 в МР3.1.0169-20 «Лабораторная диагностика COVID-19» MP 3.1.074-20, MP 3.1.0175-20 постановляю:
6070; 2008, N 29 (ч. 1), ст. 3418; 30 (ч. П), ст. 3616; 2009, 1, ст. 17; 2010, N 40, ст. 4969; 2011, N 1, ст. 6, 30 (ч. 1), ст. 4563, ст. 4590, ст. 4591, ст. 4596; 24, ст. 3069; 26, ст. 3446; 2013, N 27, ст. 3477; 30 (ч. I), ст. 4079), санитарно-эпидемиологическими правилами СП 3.1./3.2. 3146-13 «Общие требования по профилактике инфекционных и паразитарных болезней», методическими рекомендациями МР3.1.0169-20 «Лабораторная диагностика COVID-19», изменения N 1 в МР3.1.0169-20 «Лабораторная диагностика COVID-19» MP 3.1.074-20, MP 3.1.0175-20 постановляю:
1. Установить перечень медицинских организаций, коммерческих учреждений и индивидуальных предпринимателей и принадлежащих им лабораторий ПЦР-диагностики, исследования на COVID-19 которых являются окончательными на территории Ямало-Ненецкого автономного округа, в соответствии с (Приложением N 1) к постановлению.
2. Утвердить перечень контингентов, обследуемых на COVID-19 в ПЦР-лабораториях медицинских организаций и коммерческих структур Ямало-Ненецкого автономного округа, в соответствии с (Приложением N 2) к данному постановлению.
3. Рекомендовать юридическим лицам и индивидуальным предпринимателям перечень коммерческих лабораторий, допущенных к проведению исследований на COVID-19 лиц, не имеющих признаков инфекционных заболеваний и не находящихся в прямом контакте с больным новой коронавирусной инфекцией (Приложение N 3).
2. Директору Департамента здравоохранения ЯНАО (Новиков С.В.) руководителям организаций, осуществляющих медицинскую деятельность, независимо от форм собственности:
2.1. Обеспечить лабораторное подтверждение диагноза COVID-19 диагностическими тест-системами, разрешенными к применению на территории Российской Федерации.
2.2. После получения лабораторного подтверждения COVID-19 принять меры по направлению экстренных извещений в соответствии с действующим санитарным законодательством в учреждения Центра гигиены и эпидемиологии в Ямало-Ненецком автономном округе.
2. 3. При выписке больных с COVID-19 учитывать получение только 2-х отрицательных результатов лабораторных исследований с промежутком не менее одних суток.
3. При выписке больных с COVID-19 учитывать получение только 2-х отрицательных результатов лабораторных исследований с промежутком не менее одних суток.
2.4. Обеспечить однократное обследование контактных в очагах COVID-19 в день начала медицинского наблюдения, в дальнейшем при появлении (выявлении) клинических симптомов провести отбор материала и провести обследование немедленно.
3.1. Главному врачу ФБУЗ «Центр гигиены и эпидемиологии в ЯНАО» В.В. Харькову.
3.2. Обеспечить подтверждающее тестирование на базе учреждений здравоохранения ФБУЗ «Центр гигиены и эпидемиологии в ЯНАО» проб материала, поступившего из ПЦР-лабораторий, не вошедших в список, согласно (Приложению N 1) к данному постановлению.
3.3. По согласованию с управлением Роспотребнадзора по ЯНАО обеспечить проведение выборочного уточнения результатов исследований проб на COVID-19, получаемых государственными и коммерческими лабораториями, с учетом объемов и данных о результативности проводимых ими исследований.
4.1. Начальникам территориальных отделов Управления Роспотребнадзора по Ямало-Ненецкому автономному округу.
4.2. Обеспечить немедленно проведение первичного комплекса противоэпидемических мероприятий при получении информации о случаях, подозрительных на COVID-19, в том числе результатов тестирования из любой ПЦР-лаборатории ЯНАО и других субъектов Российской Федерации, внесенных в (Приложение 1) данного Постановления.
4.3. Принять меры по внесению в отчетные формы Роспотребнадзора случаев заболевания COVID-19 только по полученным экстренным извещениям или спискам, заверенным медицинской организацией.
4.4. Принять меры по контролю за исполнением данного постановления. Еженедельно, по понедельникам информировать Управление Роспотребнадзора по ЯНАО об его исполнении, до особого распоряжения.Главный государственный санитарный врач
по Ямало-Ненецкому автономному округу
Л. А.НЕЧЕПУРЕНКО
А.НЕЧЕПУРЕНКОПриложение N 1
к постановлению главного
государственного санитарного
врача по ЯНАО
от 07.05.2020 N 13ПЕРЕЧЕНЬ МЕДИЦИНСКИХ ОРГАНИЗАЦИЙ, КОММЕРЧЕСКИХ УЧРЕЖДЕНИЙ И ИНДИВИДУАЛЬНЫХ ПРЕДПРИНИМАТЕЛЕЙ И ПРИНАДЛЕЖАЩИХ ИМ ЛАБОРАТОРИЙ ПЦР-ДИАГНОСТИКИ, ИССЛЕДОВАНИЯ НА COVID-19 КОТОРЫХ ЯВЛЯЮТСЯ ОКОНЧАТЕЛЬНЫМИ НА ТЕРРИТОРИИ ЯМАЛО-НЕНЕЦКОГО АВТОНОМНОГО ОКРУГА
(в ред. постановления Главного государственного санитарного врача по ЯНАО от 13.05.2020 N 14)
N
Наименование юридического лица, ИП
Юридический адрес, адрес и место осуществления деятельности
Номер санитарно-эпидемиологического заключения, дата выдачи. Номер лицензии на медицинскую деятельность, дата выдачи
1
Государственное бюджетное учреждение здравоохранения «Салехардская окружная клиническая больница»
629001, ЯНАО, г.
 Салехард, улица Мира, дом 39, место осуществления деятельности г. Салехард, улица Мира, дом 39, литер А, А1
Салехард, улица Мира, дом 39, место осуществления деятельности г. Салехард, улица Мира, дом 39, литер А, А1Санитарно-эпидемиологическое заключение N 89.01.04.000. М.000127.06.11 от 02.06.2011, выданное Управлением Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека по ЯНАО
2
Государственное бюджетное учреждение здравоохранения ЯНАО «Новоуренгойская центральная городская больница»
629300, ЯНАО, г. Новый Уренгой, ул. Геологоразведчиков, дом 7, фактический адрес места осуществления деятельности совпадает с юридическим
Санитарно-эпидемиологическое заключение N 89.01.03.000. М.000190.10.12 от 05.10.2012, выданное Управлением Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека по ЯНАО
3
Государственное бюджетное учреждение здравоохранения ЯНАО «Ноябрьская центральная городская больница»
629806, ЯНАО, г.
 Ноябрьск, улица Муравленко, дом 42б
Ноябрьск, улица Муравленко, дом 42бСанитарно-эпидемиологическое заключение N 89. ЮД.01.000. М.000067.09.19 от 17.09.2019, выданное Управлением Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека по ЯНАО
4
Федеральное бюджетное учреждение здравоохранения «Центр гигиены и эпидемиологии в Ямало-Ненецком автономном округе»
629008 г. Салехард, ул. Ямальская, д. 4
Санитарно-эпидемиологическое заключение N 89.01.03.000. М.000133.11.18 от 13.11.2018, Лицензия на осуществление деятельности с ПБА-III-IV гр. патогенности N 77.99.03.001. Л.000933.07.05 от 17.08.2015 Лицензия на осуществление медицинской деятельности N ФС-72-01-001147 от 08.06.2018
5
Филиал ФБУЗ «Центр гигиены и эпидемиологии в ЯНАО в г.
 Новый Уренгой, Тазовском районе»
Новый Уренгой, Тазовском районе»г. Новый Уренгой, ул. Новая, 26
Санитарно-эпидемиологическое заключение N 89.01.05.000. М.000157.12.18 от 26.12.2018. Лицензия на осуществление деятельности с ПБА-III-IV гр. патогенности N 77.99.03.001. Л.000933.07.05 от 17.08.2015 Лицензия на осуществление медицинской деятельности N ФС-72-01-001147 от 08.06.2018
6
Филиал ФБУЗ «Центр гигиены и эпидемиологии в ЯНАО в г. Ноябрьск, г. Муравленко»
г. Ноябрьск, ул. Республики, 1а
Санитарно-эпидемиологическое заключение N 89.01.05.000. М.000158.12.18 от 27.12.2018. Лицензия на осуществление деятельности с ПБА III-IV гр. патогенности N 77.99.03.001. Л.000933.07.05 от 17.08.2015 Лицензия на осуществление медицинской деятельности N ФС-72-01-001147 от 08.
 06.2018
06.20187
Филиал ФБУЗ «Центр гигиены и эпидемиологии в ЯНАО в Надымском районе»
г. Надым, ул. Южная, 1
Санитарно-эпидемиологическое заключение N 89.01.03.000. М.000093.07.18 от 17.07.2018 Лицензия на осуществление деятельности с ПБА III-IV гр. патогенности N 77.99.03.001. Л.000933.07.05 от 17.08.2015 Лицензия на осуществление медицинской деятельности N ФС-72-01-001147 от 08.06.2018
8
ООО «НПФ ХЕЛИКС»
г. Москва, Электролитный пр. 3, стр. 3
Лицензия на осуществление медицинской деятельности ЛО-66-01-005901 от 15.04.2019 выдана Министерством здравоохранения Свердловской области
9.

ООО «Лаборатория Гемотест»
Московская обл., г. Люберцы, Октябрьский проспект, 183
ИНН 7709383571
10.
ООО Лаборатория «ЛитеХ»
г. Москва, ул. Малая Семеновская, 3А, стр. 2
ИНН 7718844243
11.
ООО «Клиника новых медицинских технологий «АрхиМед»
Москва, ул. Вавилова, 68, кор. 2
5003055720
(п. 11 введен постановлением Главного государственного санитарного врача по ЯНАО от 13.05.2020 N 14)
Приложение N 2
к постановлению главного
государственного санитарного
врача по ЯНАО
от 07. 05.2020 N 13
05.2020 N 13Приложение N 3
к постановлению главного
государственного санитарного
врача по ЯНАО
от 07.05.2020 N 13Субъект РФ
Организация
ИНН организации
Фактический адрес лаборатории
Начали проводить исследования
Центральный ФО
г. Москва
ООО НПФ «ХЕЛИКС»
7802122535
Москва, Электролитный пр., 3, стр. 3
ДА
АО «Семейный доктор»
7727194344
Москва, Аптекарский пер., 11
ДА
ООО «ИНКРАЙМ»
7706661968
Москва, ул.
 Новая Басманная, 10, стр. 1, эт. 5, пом. III, ком. 1
Новая Басманная, 10, стр. 1, эт. 5, пом. III, ком. 1ООО «КДЛ ДОМОДЕДОВО-ТЕСТ»
5009046778
Москва, ул. Енисейская, 37, стр. 1
ДА
ООО «Клиника ЛМС»
77004544391
Москва, ул. Кульнева, 5
ДА
ООО «Клиника новых медицинских технологий «АрхиМед»
5003055720
Москва, ул. Вавилова, 68, кор. 2
ДА
ООО «Научно-методический центр клинической лабораторной диагностики Ситилаб»
7714822471
Москва, Хорошевское ш., 43 Г, стр.
 1, ком. 1
1, ком. 1ДА
ООО «Независимая лаборатория ИНВИТРО»
7710294238
Москва, ул. Нагатинская, 1, стр. 44
ДА
CMD ФБУН ЦНИИ Эпидемиологии Роспотребнадзора
7720024671
Москва, ул. Новогиреевская, 3а
ДА
АО «ЛабКвест»
7730196038
Москва, Бережковская наб., 20, стр. 13
ДА
ООО Лаборатория «Литех»
7718844243
Москва, ул. Малая Семеновская, 3А, стр. 2
ДА
ФГБУ «Национальный медицинский исследовательский центр терапии профилактической медицины» МЗ РФ
7709024283
Москва, Петроверигский переулок, 10, стр.
 3
3ООО «Национальное агентство клинической фармакологии и фармации»
(НАКФФ)
7723628921
Москва, ул. Угрешская, 2, стр. 8, этаж 2, пом. 34
ДА
ООО «Лечебный Центр» (ООО «ЛЦ»)
7704878482
Москва, ул. Тимура Фрунзе, 15/1
ДА
ООО «МЕД-ЮТАС»
7708104092
Москва, ул. Гримау, 10 А, стр. 2
ДА
ООО «Лабораторно-диагностический центр»
7743791980
Москва, Волгоградский проспект, 42, корп. 1
ДА
ЗАО «МЦК»
7726266317
Москва, ул.
 Высокая, 19, корп. 2
Высокая, 19, корп. 2ДА
Московская область
ООО «Лаборатория Гемотест»
7709383571
Московская обл., г. Люберцы, Октябрьский просп., 183
ДА
Воронежская область
ООО Компания «Новые медицинские технологии»
3666096460
г. Воронеж, Московский просп., 11
ДА
ООО «Джалин»
3665046459
г. Воронеж, бул. Победы, 13
ДА
Калужская область
ООО «Клиника N 1»
4025426126
Калужская обл.
 ,
,г. Обнинск,
ул. Аксенова, 6 А
ДА
Северо-Западный ФО
г. Санкт-Петербург
ООО НПФ «ХЕЛИКС»
7802122535
г. Санкт-Петербург, Большой Сампсониевский просп., 20, лит. А
ДА
АО «Северо-Западный центр доказательной медицины»
7813316148
г. Санкт-Петербург, Пулковское ш., 28, лит. А, пом. 21-Н, каб. 22
ДА
АО «Ситилаб»
7801381840
г. Санкт-Петербург, 19-я линия Васильевского острова, 34, кор. 1, литер Б, пом. 63
ДА
ООО «Глобус Мед»
7814135874
г.
 Санкт-Петербург, ул. Жукова, 18Д
Санкт-Петербург, ул. Жукова, 18ДДА
ООО «Медицинская компания ЛабСтори»
7801489428
г. Санкт-Петербург, ул. Достоевского, 40-44, литер Д
ДА
ООО «ЛИИС»
7801191335
г. Санкт-Петербург, ул. Бухарестская, 134, литера А, пом. 33-Н
ДА
ООО «ЛабТест»
7804167764
г. Санкт-Петербург, ул. Минеральная, 13 А, пом. 20 Н
ДА
ООО «ЕМЛ»
7816243748
г. Санкт-Петербург,
ул. Днепропетровская,
33, лит.
 А, пом. 3 Н каб. 3
А, пом. 3 Н каб. 3ДА
ООО «Эксплана»
7813275702
г. Санкт-Петербург, ул. Академика Павлова, 14, лит. А, пом. 30 Н, ком. 1-23
ДА
Вологодская область
ООО «Центр лабораторной диагностики»
3525146502
г. Вологда,
ул. Зосимовская, 53А
ДА
Калининградская область
ООО «Медэскперт Лаб»
3904084539
г. Калининград, ул. Космонавта Леонова, 8
ДА
Новгородская область
ООО «Волна-Лаб»
5321184221
г.
 Великий Новгород, ул. Большая Санкт-Петербургская, 46а
Великий Новгород, ул. Большая Санкт-Петербургская, 46аДА
Южный ФО
Волгоградская область
ООО «КДЛ «Диалайн»
3443924952
г. Волгоград, просп. им. В.И. Ленина, 96 Б
ДА
Краснодарский край
ООО «Клиника Преображенская»
2309121029
г. Краснодар, ул. Ставропольская, 210 Д, Д1
ДА
ООО «СЛ МедикалГруп»
2308108201
г. Краснодар, ул. Московская, 96
ДА
ООО «Современные диагностические технологии»
2312106687
г.
 Краснодар, ул. Им. Калинина, 201
Краснодар, ул. Им. Калинина, 201ДА
Северо-Кавказский ФО
Кабардино-Балкарская Республика
ООО «Центральная поликлиника»
0725017675
г. Нальчик, ул. Толстого, 142
ДА
Республика Северная Осетия — Алания
ООО «Клинико-диагностическая лаборатория Дзагуров Г.К.»
1515919446
г. Владикавказ,
ул. Коцоева, 77, оф. 3
ДА
Ставропольский край
АНМО «Ставропольский краевой клинический консультативно-диагностический центр»
2634049360
г. Ставрополь, ул.
 Ленина, 304
Ленина, 304ДА
ООО «Развитие ДНК»
2635093178
г. Ставрополь, ул. Селекционная, 4/3
ДА
Приволжский ФО
Республика Башкортостан
ООО «Медицинский Центр Меги»
0278069100
г. Уфа, ул. Менделеева, 134/7
ДА
ООО «Центр лабораторной диагностики»
0277132053
г. Уфа, просп. Октября, 83, стр. 3
ДА
ООО МедиаЛаб
274131950
г.
 Уфа, ул. Кирова, 44
Уфа, ул. Кирова, 44ДА
ООО «Исследовательский центр «Лаборатория»
0277044537
Республика Башкортостан, Уфимский район, с. Булгаково, ул. Кирова, 9
ДА
Республика Татарстан
ООО «Ситилаб» г. Казань
1660085820
г. Казань,
ул.
Интернациональная,
43
ДА
ООО ЛДЦ «Биомед»
1655262224
г. Казань,
ул. Техническая,
120В
ДА
Удмуртская Республика
ООО «МедЛаб Экспресс»
1841012006
г.
 Ижевск,
Ижевск,ул. Удмуртская, 265, кор. 1
ДА
Кировская область
ООО «Централизованная клинико-диагностическая лаборатория»
4345118466
г. Киров, ул. Павла Корчагина, 227, оф. 43
ДА
ООО «Медэксперт»
4345445520
г. Киров,
Октябрьский просп., 29 А
ДА
Нижегородская область
ООО «Централизованная лаборатория «АВК-Мед»
5260156369
г. Нижний Новгород, пер. Спортсменский, 12
ДА
Самарская область
ЗАО «Медицинская компания ИДК»
6318323477
г.
 Самара, Волжское ш., 70
Самара, Волжское ш., 70ДА
ООО «Ситилаб»
6319115960
г. Самара, ул. Алма-Атинская, 72, литер 1
ДА
ООО «Наука ПЦР»
6316198397
г. Самара, ул. Ново-Садовая, 106, к. 82, оф. 28
ДА
ООО «СКАЙЛАБ»
6316205446
г. Самара,
Заводское ш., 14, лит. В
Саратовская область
ООО «Медицинский Ди Центр»
6449034126
г. Энгельс,
ул. Горького, 26
ДА
Ульяновская область
ФГБОУ ВО «Ульяновский государственный педагогический университет имени И.
 Н. Ульянова»
Н. Ульянова»7325001698
г. Ульяновск, пл. Ленина, 4/5
ДА
ООО «Академия+»
7325152320
г. Ульяновск, ул. Шолмова, 35
ДА
ООО «Медозон+»
7328090449
г. Ульяновск, ул. Тюленева, 4 Б
ДА
Уральский ФО
Курганская область
ООО «ЦМГЭ»
4501182729
г. Курган, ул. Гоголя, 109 А
ДА
Свердловская область
ООО Медицинско-фармацевтический центр «Гармония»
6664012484
г.
 Екатеринбург, ул. Фурманова, 30
Екатеринбург, ул. Фурманова, 30ДА
ООО «Ситилаб-Урал»
6674223830
г. Екатеринбург, ул. 8 Марта, 207/1
ДА
Тюменская область
ООО «Доктор АРБИТАЙЛО»
7202201665
г. Тюмень,
ул. Широтная, 130, кор. 1
ДА
ООО «Мать и дитя Тюмень»
7203392395
г. Тюмень,
ул. Комсомольская,
22
ДА
Ханты-Мансийский АО — Югра
ООО МЦ «Вира»
8604012765
г. Нефтеюганск, мкр.
 11-й, 26, офис 3
11-й, 26, офис 3ДА
Ямало-Ненецкий АО
ООО «СКАНЕР»
8904002920
г. Новый Уренгой, ул. Таежная, 42 А
ДА
Челябинская область
ООО «ИНВИТРО-Урал»
7451097559
г. Челябинск,
ул. Российская, 281 Б
ДА
ООО «Прогрессивные Медицинские Технологии»
7448094406
г. Челябинск, Комсомольский просп., 45, кор. А
ДА
ООО Медицинский центр «Лотос»
7452039662
г. Челябинск, ул.
 Труда, 187 Б
Труда, 187 БДА
ГАУЗ «Городская больница N 2 г. Магнитогорск»
7444056777
г. Магнитогорск, ул. Уральская, 50
Сибирский ФО
Республика Бурятия
ООО Медицинский центр «Диагрупп» («Диамед»)
0326036852
г. Улан-Удэ, ул. Хахалова, 12А
ДА
Алтайский край
ООО Клинико-диагностическая лаборатория «Здоровье»
2222800354
г. Барнаул,
ул. Сухэ Батора, 37
ООО «Хелми»
2224166292
г.
 Барнаул,
Барнаул,ул. Пушкина, 70
ДА
ООО МЦ «Лаборатория ДНК-Диагностики»
2222058799
г. Барнаул,
просп. Космонавтов,
12, лит. 17
ДА
ООО «ЦВМР «Галатея»
2225070593
г. Барнаул,
ул. Шевченко, 152
КГБУЗ «Консультативно-диагностический центр, г. Бийск»
2204001711
г. Бийск, ул. Советская, 33
Красноярский край
ООО «Центр лабораторных технологий АБВ»
2464122080
г. Красноярск, просп. Имени Газеты «Красноярский рабочий», 160, пом.
 20
20ДА
ООО «РЛДЦ ИХМИ»
2465069337
г. Красноярск, просп. Имени Газеты «Красноярский рабочий», 27
ДА
Иркутская область
ООО «ЮНИЛАБ-Иркутск»
3849025522
г. Иркутск, ул.
Фридриха Энгельса, 86
ДА
Новосибирская область
ООО «МБС-Технология»
5408011142
г. Новосибирск, ул. Инженерная, 28, кор. 31
ДА
ООО «ИНВИТРО-Сибирь»
5402525254
г. Новосибирск, ул. Римского-Корсакова, 9
ДА
Институт химической биологии и фундаментальной медицины СО РАН
5408100233
г.
 Новосибирск, ул. Пирогова, 25/4
Новосибирск, ул. Пирогова, 25/4ДА
Омская область
ООО «Многопрофильный центр современной медицины «Евромед»
5504248023
г. Омск, ул. Съездовская, 29, кор. 3
ДА
Томская область
ООО «Лаборатория современной диагностики» (ООО «ЛСД»)
7017299631
г. Томск,
ул. Чулымский тракт,
15, стр. 3
ДА
ООО «Медицинский научно-практический центр»
7021049962
г. Томск,
ул. Котовского, 19
ФГБОУ ВО «Сибирский государственный медицинский университет» МЗ РФ
7018013613
г.
 Томск, Московский тракт, 2
Томск, Московский тракт, 2Дальневосточный ФО
Приморский край
ООО Диагностический центр «Лабораторная диагностика-Асклепий»
2538126251
г. Владивосток, ул. Гамарника, 3 Б
ДА
ООО МЛ «ТАФИ-Диагностика»
2536242157
г. Владивосток, ул. Садовая, 25 б
ДА
Чем нас лечат: тесты на коронавирус
Для анализа на коронавирус часто используются наборы для так называемых ОТ-ПЦР в реальном времени — более быстрая и автоматизированная версия, позволяющая определить количество новых копий после каждого цикла. ПЦР-тесты на коронавирус длятся в среднем от 40 минут до 2–3 часов.
 В качестве участка для распознавания они используют ген N, ген E и другие фрагменты вирусного генома (обычно это несколько участков, чтобы снизить вероятность ошибок).
В качестве участка для распознавания они используют ген N, ген E и другие фрагменты вирусного генома (обычно это несколько участков, чтобы снизить вероятность ошибок).Лже- и лже-
Для проведения ПЦР может послужить разный биологический материал, который относительно легко собрать: мазок из носоглотки, горла, слюна или мокрота. Считается, что слюну собирать проще всего: плюнуть в пробирку человек может и без участия врачей и лаборантов, что делает их работу безопаснее. Для самих пациентов, в том числе людей на карантине, этот подход может быть более удобным. Однако у ученых есть сомнения, что в слюне концентрация частиц коронавируса будет достаточной для анализа (хотя есть и данные в пользу того, что тесты со слюной даже точнее). Но в течение болезни их концентрация в носоглотке и горле тоже меняется. После первой недели вирус в основном переходит в легкие и уже не так интенсивно будет размножаться там, откуда обычно берут образцы.
Из-за этого у анализа, взятого в первые дни появления симптомов, точность такого теста будет выше 94%, так как количество вирусных частиц, как мы помним из графика, будет высоким (105–106 на миллилитр), и даже не самые высокочувствительные системы для анализа смогут их обнаружить.
 Более того, и при бессимптомном течении болезни вирусных частиц будет достаточно много для обнаружения. Но уже к десятому дню точность резко падает: вероятность ложноотрицательного диагноза достигает 33%! Неудивительно, что перед выпуском из карантина больных проверяют три-четыре раза.
Более того, и при бессимптомном течении болезни вирусных частиц будет достаточно много для обнаружения. Но уже к десятому дню точность резко падает: вероятность ложноотрицательного диагноза достигает 33%! Неудивительно, что перед выпуском из карантина больных проверяют три-четыре раза.Помимо ПЦР в реальном времени есть и более срочные варианты, например на основе петлевой изотермальной амплификации (LAMP). Как можно понять из названия, он тоже основан на размножении копий нужных фрагментов. Но если в классических версиях ПЦР нужна строго определенная температура для каждого этапа этого копирования (и весь процесс проходит в специальном приборе — термоциклере), при экспресс-тестах все проходит при одной температуре, что и сокращает время.
Также различают такие понятия, как чувствительность и специфичность тестов. Первое означает, что анализ четко показывает наличие вируса. Так, чувствительность в 90% будет означать, что 10% инфекций не будет обнаружено (ложноотрицательный результат).
 Специфичность же подразумевает, что тест избирателен и не спутает искомый фрагмент вируса ни с чем другим. Эти случаи станут ложноположительными результатами. Низкоспецифичные тесты будут иметь низкую положительно прогностическую значимость, особенно если в популяции мало больных. Так, если заболевших будет всего 5%, то протестировав 100 человек с ошибкой в 5%, мы получим 5 действительно больных и 5 ложноположительных результатов и среди наших 10 диагнозов лишь половина будет верна.
Специфичность же подразумевает, что тест избирателен и не спутает искомый фрагмент вируса ни с чем другим. Эти случаи станут ложноположительными результатами. Низкоспецифичные тесты будут иметь низкую положительно прогностическую значимость, особенно если в популяции мало больных. Так, если заболевших будет всего 5%, то протестировав 100 человек с ошибкой в 5%, мы получим 5 действительно больных и 5 ложноположительных результатов и среди наших 10 диагнозов лишь половина будет верна.Опираясь на эти знания, можно сказать, что для людей без симптомов будет лучше использовать наборы с высокой чувствительностью, тогда как при наличии симптомов количество вирусных частиц обычно выше, и засечь их могут даже менее чувствительные методы.
Самым чувствительным считается ПЦР в реальном времени. Однако его почти безупречные результаты в лабораторных условиях увы, не согласуются с точностью в реальных клиниках, которая падает до 88 или даже 66%.
А что у нас?
В России еще в апреле стали доступны восемь вариантов ПЦР-тестов, прошедших ускоренную регистрацию.
 Это изменило ситуацию с монополией ГНЦ «Вектор», поначалу поставлявшего наборы с невысокой чувствительностью (105 молекул на миллилитр), требующие для обратной транскрипции дополнительных реагентов. Новые наборы стали более чувствительными (от 500 до 10 000 молекул на миллилитр в образце), в них есть внутренний контрольный образец (молекула, которая помогает обнаружить, что реакция прошла не так при ошибке лаборанта). Лидерами рынка с самым масштабным производством (кроме ГНЦ «Вектор») стали ЦНИИ эпидемиологии Роспотребнадзора, «Вектор-Бест» (не путать с ГНЦ «Вектор) и «ДНК-Технологии». Очень высокая заявленная точность также и у теста от Центра стратегического планирования Минздрава.
Это изменило ситуацию с монополией ГНЦ «Вектор», поначалу поставлявшего наборы с невысокой чувствительностью (105 молекул на миллилитр), требующие для обратной транскрипции дополнительных реагентов. Новые наборы стали более чувствительными (от 500 до 10 000 молекул на миллилитр в образце), в них есть внутренний контрольный образец (молекула, которая помогает обнаружить, что реакция прошла не так при ошибке лаборанта). Лидерами рынка с самым масштабным производством (кроме ГНЦ «Вектор») стали ЦНИИ эпидемиологии Роспотребнадзора, «Вектор-Бест» (не путать с ГНЦ «Вектор) и «ДНК-Технологии». Очень высокая заявленная точность также и у теста от Центра стратегического планирования Минздрава.Частные компании «Гемотест» и «Хеликс» используют анализ от «Вектора». «Инвитро» делает более точные тесты с «Вектор-Бест», но попасть к ним на анализ просто так нельзя: они принимают только образцы в контейнерах от государственных клиник. LabQuest предлагает тесты «ДНК-технологии», «Литеха» и экспресс-тест от «Генериума», а тест ЦНИИ эпидемиологии делают в компании CMD, выезжающей на дом с курьером.
 Лаборатории, одобренные Роспотребнадзором, можно найти здесь.
Лаборатории, одобренные Роспотребнадзором, можно найти здесь.Проблема с российскими тестами состоит в том, что мы не располагаем независимыми данными по их сравнительной проверке. Так что приходится доверять лишь их заявленной чувствительности, держа в уме, что в целом есть риск ложноотрицательных результатов из-за несовершенства доступных нам методов, которые лучше всего выявляют коронавирус в первые дни проявления симптомов. А поскольку сдать анализ по своему желанию в поликлинику не так-то просто и быстро, а услуги частных компаний недешевые, то можно понять, почему раннее тестирование — это идеал, но не всегда достижимый. Вариант с получением биоматериала прямо из легких не назовешь удобным и легко масштабируемым (хотя в некоторых тестах используется мокрота, что уже точнее, чем слюна).
К счастью, как мы уже упоминали, есть и другие тесты и диагностические методы, которые помогут обнаружить не вирусные частицы, а различные проявления болезни. Для этого делаются, например, анализы на антитела и компьютерная томография, о которой мы поговорим во второй части статьи.

Продолжение следует
Понравился материал? Добавьте Indicator.Ru в «Мои источники» Яндекс.Новостей и читайте нас чаще.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram, Одноклассники.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.
Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.

- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.

Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера на прием файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.
 Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.

Helix получает расширенное разрешение на использование в экстренных случаях для неконтролируемого самостоятельного сбора на месте и бессимптомного скрининга с помощью теста Helix® COVID-19 Test
САН-МАТЕО, Калифорния, 26 октября 2020 г. / PRNewswire / — Helix, ведущая компания в области популяционной геномики, объявила о получении расширенного разрешения на использование в чрезвычайных ситуациях (EUA) от США.Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) для теста Helix Ⓡ COVID-19. Благодаря этому расширению люди теперь могут самостоятельно собирать образцы без надзора со стороны медицинского работника. Кроме того, теперь тест показан для использования у лиц без симптомов для скрининга или популяционного тестирования.
Устраняя необходимость в медицинском работнике для наблюдения за сбором, как в настоящее время требуется для большинства тестов на COVID-19, организации, использующие тест Helix ® COVID-19, получат значительно большую гибкость в том, как они встают и управляют участками тестирования и центры сбора.
 Это также помогает снизить затраты на сбор и решить проблему нехватки клинического персонала по всей стране, чтобы эти ресурсы были направлены туда, где они больше всего нужны.
Это также помогает снизить затраты на сбор и решить проблему нехватки клинического персонала по всей стране, чтобы эти ресурсы были направлены туда, где они больше всего нужны.«Масштабирование быстрого и надежного тестирования COVID-19 — это не только научная или технологическая проблема, но и серьезная логистическая проблема», — сказал Марк Стэпли, генеральный директор Helix. «Это расширение нашего EUA для обеспечения самостоятельного сбора на месте помогает нашему правительству, образовательным учреждениям и партнерам-работодателям значительно оптимизировать свои операции, снизить затраты на сбор и более быстро расширить доступ к тестированию на COVID-19.«
Благодаря расширенному EUA Helix также становится одной из немногих лабораторий, уполномоченных проводить тестирование бессимптомных лиц на COVID-19, что является важной частью любой стратегии безопасного открытия школ и рабочих мест. Однако тестирование бессимптомных людей требует очень чувствительного теста. Недавний отчет от FDA, сравнивающий более 75 других тестов, показал, что тест Helix ® COVID-19 является одним из самых чувствительных на рынке.

«Возможность широкого тестирования людей независимо от симптомов имеет решающее значение для обеспечения того, чтобы мы могли предотвращать и смягчать вспышки и выявлять людей как можно раньше в процессе заражения», — сказал д-р.Джеймс Лу, доктор медицинских наук, соучредитель и президент Helix. «Кроме того, снижение барьеров для тестирования позволяет нам охватить некоторые из наиболее уязвимых и недостаточно обслуживаемых групп населения в США».
Тест Helix ® COVID-19 является частью комплексной тестовой системы Helix, которая включает неинвазивный набор для сбора и обработку образцов в лаборатории высокой сложности Helix, сертифицированной CLIA, аккредитованной CAP в Сан-Диего. , время обработки на следующий день с момента получения образцов и возврата результатов заказывающему медицинскому работнику, испытуемому лицу и органам общественного здравоохранения.С момента запуска этой системы Helix обеспечила средний срок обработки 14 часов с момента получения образца в лаборатории Helix.

Сегодня Helix предоставляет услуги тестирования на COVID-19 системам здравоохранения, работодателям, правительствам, розничным аптекам и другим организациям по всей стране. Благодаря этим дополнительным показаниям нынешние и будущие партнеры Helix значительно увеличили гибкость в развертывании тестирования в своих сообществах.
Тест Helix ® COVID-19 был разрешен FDA в соответствии с EUA для использования в уполномоченных лабораториях.Этот тест не был одобрен или одобрен FDA. Этот тест был разрешен только для обнаружения нуклеиновой кислоты от SARS-CoV-2, но не для каких-либо других вирусов или патогенов. Этот тест разрешен только на период действия заявления о существовании обстоятельств, оправдывающих разрешение экстренного использования диагностических тестов in vitro для обнаружения и / или диагностики COVID-19 в соответствии с разделом 564 (b) (1) Закона, 21 U.S.C. § 360bbb-3 (b) (1), если авторизация не будет прекращена или отозвана раньше.

Дополнительная информация, включая важную информацию о тестах и ограничениях, доступна по адресу helix.com/COVID .
О компании Helix
Helix — ведущая компания в области популяционной геномики, работающая на стыке клинической помощи, исследований и геномики. Его сквозная платформа позволяет системам здравоохранения, медико-биологическим компаниям и плательщикам продвигать геномные исследования и ускорять интеграцию геномных данных в клиническую помощь. Работая на базе одной из крупнейших в мире лабораторий секвенирования нового поколения CLIA / CAP и своего патентованного анализа Exome + ®, Helix поддерживает все аспекты популяционной геномики, включая набор и участие, клинически действенный скрининг болезней, возврат результатов, а также базовые и трансляционные исследования.В ответ на кризис общественного здравоохранения, связанный с COVID-19, Helix запустила чувствительную и масштабируемую систему сквозного тестирования COVID-19 для удовлетворения потребностей систем здравоохранения, работодателей, правительств и других организаций по всей стране.
 Узнайте больше на www.helix.com.
Узнайте больше на www.helix.com.ИСТОЧНИК Helix
Ссылки по теме
http://www.helix.com
Избирательная модуляция химических и электрических синапсов нейронных сетей Helix при развитии in vitro | BMC Neuroscience
Экспериментальные данные, собранные MEA и представленные в этой работе, были получены для 8 культур Helix , мониторинг которых проводился через 6, 24, 36, 48, 54 и 72 часа после посева.Как объяснялось в разделе «Методы», мы рассматривали 3 культуры, обработанные серотонином (5-HT), 2 культуры с высоким содержанием внеклеточного калия (KCl) и 3 в качестве контроля, то есть без какой-либо обработки.
Полисинаптические цепи Helix демонстрируют зависящую от лечения длительную активностьКогда нейроны Helix культивируются in vitro, они не проявляют никакой спонтанной электрической активности [10]. Мы проследили развитие (от 6 до 72 часов после посева) 3 культур, состоящих из 12 B2 и 4 C1 нейронов, расположенных в конфигурации, изображенной на рисунке 1A.
Рисунок 1 В каждый момент времени мы регистрировали 30 минут спонтанной активности: в 3 нестимулированных культурах не наблюдалось никакой всплесковой активности. Чтобы проверить работоспособность сетей и эффективное присутствие синаптических связей, мы провели электрическую стимуляцию в час 72, и . Выбранные клетки были индивидуально пронзены и стимулированы импульсом тока, амплитуда которого была достаточной для преодоления порога возбудимости. В этих условиях мы могли наблюдать сетевую активность, в которой участвовали все нейроны сети (данные не показаны).
В каждый момент времени мы регистрировали 30 минут спонтанной активности: в 3 нестимулированных культурах не наблюдалось никакой всплесковой активности. Чтобы проверить работоспособность сетей и эффективное присутствие синаптических связей, мы провели электрическую стимуляцию в час 72, и . Выбранные клетки были индивидуально пронзены и стимулированы импульсом тока, амплитуда которого была достаточной для преодоления порога возбудимости. В этих условиях мы могли наблюдать сетевую активность, в которой участвовали все нейроны сети (данные не показаны).Схематическое изображение сетевой организации и исходных данных. ( A ) Примерная схема размещения нейрона на МЭБ. Красные и синие квадраты указывают положение ячеек C1 и B2 соответственно. Число внутри квадратов указывает положение электрода в схеме MEA. ( B ) 1 секунда активности от микроэлектрода с нейроном C1. ( C ) 1 секунда активности, исходящая от микроэлектрода с нейроном B2.

Чтобы вызвать электрофизиологическую активность в сетях Helix , мы химически обрабатывали такие культуры с помощью двух протоколов стимуляции в каждый момент времени регистрации: i) Повышение внеклеточной концентрации калия (KCl) с 5 мМ до 65 мМ, что приводит к общая деполяризация мембранных потенциалов клеток; ii) доставка серотонина (5-HT) в концентрации, равной 20 мкМ, которая избирательно деполяризует нейроны B2. Детали этих протоколов описаны в разделе «Методы».
На рис. 2 показаны качественные результаты для одной культуры, обработанной KCl. Каждый горизонтальный блок на рисунке представляет собой момент времени записи (т.е. 6, 24, 36, 48, 54, 72 часа). Три растровых графика для каждого блока показывают одну минуту электрофизиологической активности до, во время и после доставки KCl. Красные и синие линии относятся к нейронам C1 и B2 соответственно. Первое наблюдение состоит в том, что KCl индуцировал временную деполяризацию сети, которая длилась не более 1 минуты: нейроны быстро деполяризовались с задержкой 825 ± 43 мс от доставки KCl.
Рисунок 2 В результате устойчивой деполяризации мембраны сети переходили в состояние покоя перед вымыванием, возможно, из-за инактивации потенциалзависимых натриевых каналов. Фазы до и после стимуляции KCl в основном характеризовались отсутствием активности: до стимуляции сети Helix всегда были полностью молчаливыми (см. Также график IFR, представленный на рисунке 3A). После промывки сеть перешла в состояние покоя, в котором не было зарегистрировано никакой активности: время от времени обнаруживались лишь небольшие колебания в нейронах B2, как показано на рисунке 3A.Основное наблюдение на этих растровых графиках и на кривых IFR за 24–72 часа разработки заключается в том, что KCl не вызывает постоянной активности в сети. Это переходное поведение было постоянным для всех периодов записи во время разработки.
В результате устойчивой деполяризации мембраны сети переходили в состояние покоя перед вымыванием, возможно, из-за инактивации потенциалзависимых натриевых каналов. Фазы до и после стимуляции KCl в основном характеризовались отсутствием активности: до стимуляции сети Helix всегда были полностью молчаливыми (см. Также график IFR, представленный на рисунке 3A). После промывки сеть перешла в состояние покоя, в котором не было зарегистрировано никакой активности: время от времени обнаруживались лишь небольшие колебания в нейронах B2, как показано на рисунке 3A.Основное наблюдение на этих растровых графиках и на кривых IFR за 24–72 часа разработки заключается в том, что KCl не вызывает постоянной активности в сети. Это переходное поведение было постоянным для всех периодов записи во время разработки.Пример культуры Helix , обработанной с помощью приложений KCl. Каждый блок представляет собой момент времени записи (т.
Рисунок 3 е. 6, 24, 36, 48, 54, 72 часа после нанесения покрытия).В первом столбце показано развитие ветвлений нейритов (масштабная полоса 200 мкм). Три столбца растровых графиков показывают одну минуту электрофизиологической активности непосредственно до, во время и после обработки KCl. Красные и синие линии обозначают нейроны C1 и B2 соответственно. Шкала шкалы 10 с.
е. 6, 24, 36, 48, 54, 72 часа после нанесения покрытия).В первом столбце показано развитие ветвлений нейритов (масштабная полоса 200 мкм). Три столбца растровых графиков показывают одну минуту электрофизиологической активности непосредственно до, во время и после обработки KCl. Красные и синие линии обозначают нейроны C1 и B2 соответственно. Шкала шкалы 10 с.Характеристики срабатывания сетей Helix . Мгновенная скорость стрельбы (IFR) ( A , B ) и средняя скорость стрельбы (MFR) ( C , D ), усредненные по всему набору данных для культур, обработанных KCl (A, C) и 5 -HT (B, D).Нейроны C1 и B2 обозначены красным и синим цветами соответственно.
И наоборот, длительная нейронная активность в сетях, обработанных 5-HT, не наблюдалась. На Рисунке 4, в графическом исполнении с тем же расположением, что и на Рисунке 2, показан пример сети Helix , обработанной 5-HT.
Рисунок 4 За исключением растровых графиков первого блока (первый и третий столбцы, т. Е. До и после стимуляции 5-HT, соответственно), нейроны продолжали активироваться после вымывания (третий столбец) и несколько часов спустя (первый столбец). ).Доставка 5-HT, по-видимому, запускает нейронные сетевые схемы в колебательное состояние, которое сохраняется в течение длительного времени во время развития сети. Мы оценили частоту квазипериодического поведения ячеек C1 и B2, вычислив обратную величину ISI. После перехода в периодический режим мы обнаружили, что нейроны C1 активировались с частотой от 0,2 Гц во время фазы перед стимуляцией до 0,6 Гц во время стимуляции, а затем снижались до 0,3 Гц в фазе после стимуляции.Эти значения поддерживались во время развития сети. В2-нейроны показали частоту срабатывания около 1 Гц во время периодического режима. Чтобы оценить, была ли активная стрельба периодической, мы вычислили коэффициент вариации (CV) ISI. Устанавливая произвольный порог на 0,2, мы считали квазипериодическими те нейроны, у которых CV меньше 0,2.
За исключением растровых графиков первого блока (первый и третий столбцы, т. Е. До и после стимуляции 5-HT, соответственно), нейроны продолжали активироваться после вымывания (третий столбец) и несколько часов спустя (первый столбец). ).Доставка 5-HT, по-видимому, запускает нейронные сетевые схемы в колебательное состояние, которое сохраняется в течение длительного времени во время развития сети. Мы оценили частоту квазипериодического поведения ячеек C1 и B2, вычислив обратную величину ISI. После перехода в периодический режим мы обнаружили, что нейроны C1 активировались с частотой от 0,2 Гц во время фазы перед стимуляцией до 0,6 Гц во время стимуляции, а затем снижались до 0,3 Гц в фазе после стимуляции.Эти значения поддерживались во время развития сети. В2-нейроны показали частоту срабатывания около 1 Гц во время периодического режима. Чтобы оценить, была ли активная стрельба периодической, мы вычислили коэффициент вариации (CV) ISI. Устанавливая произвольный порог на 0,2, мы считали квазипериодическими те нейроны, у которых CV меньше 0,2. Дополнительный файл 1 показывает тренды как CV, так и частоты. Сети, обработанные KCl, никогда не проявляли квазипериодического поведения, так как CV всегда был больше 0.2.
Дополнительный файл 1 показывает тренды как CV, так и частоты. Сети, обработанные KCl, никогда не проявляли квазипериодического поведения, так как CV всегда был больше 0.2.Пример культуры Helix , обработанной с помощью приложений 5-HT. Каждая линия представляет собой момент времени записи (т.е. 6, 24, 36, 48, 54, 72 часа после нанесения покрытия). В первом столбце показано развитие ветвлений нейритов (масштабная полоса 200 мкм). Три столбца растровых графиков, как на рисунке 2. Красные и синие линии обозначают нейроны C1 и B2 соответственно. Шкала шкалы 10 с.
Чтобы лучше проанализировать механизмы, лежащие в основе длительной активности, вызванной 5-HT, мы дополнительно охарактеризовали сети Helix , чтобы оценить, связано ли это событие с изменениями возбудимости клеток или, альтернативно, с модификациями морфологической и функциональной связности. .
Сети Helix демонстрируют стабильную динамику во время развитияСледуя подходу, используемому для характеристики in vitro развития кортикальных нейронов млекопитающих, связанных с MEAs [12, 13], мы сначала количественно оценили среднюю скорость возбуждения (MFR) и межспайковый интервал (ISI).
 На рис. 3A и B показаны тренды IFR нейронов C1 (красный) и B2 (синий). При сравнении тенденций IFR культур, обработанных KCl (рис. 3A) и 5-HT (рис. 3B), основным отличием было полное отсутствие электрофизиологической активности в нейронах C1 и B2 до стимуляции KCl.Напротив, 5-HT индуцировал низкочастотную (<5 Гц) базовую активность, особенно в клетках B2. Во время развития заметных различий замечено не было: в культурах, стимулированных KCl, мы наблюдали быстрое повышение активности сразу после стимуляции, которое длилось менее 1 минуты. Как в нейронах C1, так и в B2, IFR достиг максимального значения 20 Гц. В случае стимуляции 5-HT IFR после резкого увеличения оставался стабильным на протяжении всей фазы стимуляции. При разработке принципиальных отличий не наблюдалось.Нейроны C1 и B2 запускались очень регулярно: нейроны B2 запускались с более высокой частотой, чем C1, и эта активность сохранялась до вымывания. Впоследствии, после короткого переходного процесса (от 2 до 5 минут), характеризующегося периодом молчания, нейроны B2 спонтанно возобновили работу.
На рис. 3A и B показаны тренды IFR нейронов C1 (красный) и B2 (синий). При сравнении тенденций IFR культур, обработанных KCl (рис. 3A) и 5-HT (рис. 3B), основным отличием было полное отсутствие электрофизиологической активности в нейронах C1 и B2 до стимуляции KCl.Напротив, 5-HT индуцировал низкочастотную (<5 Гц) базовую активность, особенно в клетках B2. Во время развития заметных различий замечено не было: в культурах, стимулированных KCl, мы наблюдали быстрое повышение активности сразу после стимуляции, которое длилось менее 1 минуты. Как в нейронах C1, так и в B2, IFR достиг максимального значения 20 Гц. В случае стимуляции 5-HT IFR после резкого увеличения оставался стабильным на протяжении всей фазы стимуляции. При разработке принципиальных отличий не наблюдалось.Нейроны C1 и B2 запускались очень регулярно: нейроны B2 запускались с более высокой частотой, чем C1, и эта активность сохранялась до вымывания. Впоследствии, после короткого переходного процесса (от 2 до 5 минут), характеризующегося периодом молчания, нейроны B2 спонтанно возобновили работу. В этой постстимульной фазе динамика, демонстрируемая сетями, обработанными KCl, была более нерегулярной: нейроны C1 всегда находились в состоянии покоя во время развития, тогда как нейроны B2 демонстрировали пик активности в 48--й час .Затем IFR замедлился на 54 -й час до нуля на 72 -й час.
В этой постстимульной фазе динамика, демонстрируемая сетями, обработанными KCl, была более нерегулярной: нейроны C1 всегда находились в состоянии покоя во время развития, тогда как нейроны B2 демонстрировали пик активности в 48--й час .Затем IFR замедлился на 54 -й час до нуля на 72 -й час.Количественно оценив количество всплесков, генерируемых сетями, стимулированными KCl или 5-HT во время разработки, мы вычислили MFR, как показано на рисунках 3C и 3D. При усреднении по временному окну 30 минут пики MFR для нейронных сетей Helix , обработанных KCl, и 5-HT достигли значений 0,4 и 1,5 импульса в секунду, соответственно. В частности, мы обнаружили, что максимальное значение MFR для сети, обработанной 5-HT, равно 1.16 ± 0,16 (нейроны B2) и 1,48 ± 0,27 (нейроны C1) ударов в секунду во время фазы стимуляции в временной точке 72 nd часов. Для манипуляции с KCl пик активности возбуждения 0,29 ± 0,41 (нейроны B2) и 0,32 ± 0,45 (нейроны C1) уд / с был достигнут через 48 часов после посева в фазе после стимуляции.
 Интересно, что значения MFR были статистически одинаковыми во время разработки (рисунки 3C и D), что позволяет предположить, что пиковая активность была стабильной, хотя возможности подключения к сети менялись и развивались (см., Рисунки 2, 4 и 7).
Интересно, что значения MFR были статистически одинаковыми во время разработки (рисунки 3C и D), что позволяет предположить, что пиковая активность была стабильной, хотя возможности подключения к сети менялись и развивались (см., Рисунки 2, 4 и 7).Чтобы лучше количественно оценить возможные изменения в динамике сети во время разработки in vitro, мы вывели распределение межспайкового интервала (ISI), как показано на рисунке 5. На рисунках 5A и B показаны распределения ISI относительно фаз стимуляции (т. Е. 5- HT (серый), KCl (черный)) для нейронов C1 и B2 соответственно. Мы обнаружили, что KCl вызывает более быструю пиковую активность, чем 5-HT: нейроны C1 (рис. 5A) и B2 (рис. 5B) при стимуляции KCl (черная линия) демонстрируют основной пик ISI меньше 0.5 с, в то время как обработка 5-HT (серая линия) сдвинула такие пики для нейронов C1 и B2 в сторону 1 с. Латентность основного пика (предпочтительный интервал между спайками) не показала статистически значимых различий во время развития как для нейронов C1 и B2, так и для обеих стимуляций (см.
Рисунок 5 Фиг. 5C и D). Таким образом, сравнивая культуры, обработанные KCl и 5-HT, мы обнаружили статистически значимое различие в положении временного пика ISI (Kruskal-Wallis, непараметрический тест, P <0.01).
Фиг. 5C и D). Таким образом, сравнивая культуры, обработанные KCl и 5-HT, мы обнаружили статистически значимое различие в положении временного пика ISI (Kruskal-Wallis, непараметрический тест, P <0.01).Интервал между спайками (ISI), характеризующий сети Helix . ( A , B ) Распределение ISI относительно фаз стимуляции для нейронов ( A ) C1 и ( B ) B2. Обработка 5-HT и KCl обозначена серым и черным цветами соответственно. Ширина бина = 20 мс. ( C , D ) Положение временного пика распределений ISI относительно нейронов C1 ( C ) и B2 ( D ) соответственно.(Краскал-Уоллис, непараметрический тест, P <0,01)
Синаптически изолированные нейроны
Helix не показывают изменений возбудимости при лечении 5-HT и KClДля оценки изменений, вызванных 5-HT или KCl Что касается возбудимости нейронов, мы измерили биофизические параметры культивируемых изолированных нейронов C1 и B2, используя методы внутриклеточной записи.
Рисунок 6 К этим клеткам применяли те же процедуры культивирования и обработки, которые описаны для устройств MEA.Мы проанализировали как спонтанную, так и возбуждающую активность, вызванную стимулом деполяризации, примененным через 6 часов после нанесения покрытия, до обработки и вскоре после вымывания обработки (рис. 6А). Более того, те же клетки снова регистрировали через 24 часа после посева, чтобы проверить наличие долговременных эффектов. Как правило, через 6 часов после посева нейроны B2 проявляли низкочастотную спонтанную активность до лечения ( n = 8 в каждой группе; фигура 6B). Эти клетки сильно увеличили свою активность возбуждения после вымывания 20 мкМ серотонина, нанесенного в течение 10 минут, переключив их скорость возбуждения с 0.От 06 ± 0,06 до 0,72 ± 0,14 импульсов / с (против 0,12 ± 0,07 всплесков / с в контрольной группе; P <0,001, апостериорный тест Бонферрони ). После вымывания раствора с высоким содержанием KCl не наблюдалось значительных изменений, что подтверждает, что вымывание полностью снижает активность, индуцированную калием.
К этим клеткам применяли те же процедуры культивирования и обработки, которые описаны для устройств MEA.Мы проанализировали как спонтанную, так и возбуждающую активность, вызванную стимулом деполяризации, примененным через 6 часов после нанесения покрытия, до обработки и вскоре после вымывания обработки (рис. 6А). Более того, те же клетки снова регистрировали через 24 часа после посева, чтобы проверить наличие долговременных эффектов. Как правило, через 6 часов после посева нейроны B2 проявляли низкочастотную спонтанную активность до лечения ( n = 8 в каждой группе; фигура 6B). Эти клетки сильно увеличили свою активность возбуждения после вымывания 20 мкМ серотонина, нанесенного в течение 10 минут, переключив их скорость возбуждения с 0.От 06 ± 0,06 до 0,72 ± 0,14 импульсов / с (против 0,12 ± 0,07 всплесков / с в контрольной группе; P <0,001, апостериорный тест Бонферрони ). После вымывания раствора с высоким содержанием KCl не наблюдалось значительных изменений, что подтверждает, что вымывание полностью снижает активность, индуцированную калием. Те же клетки снова тестировали через 24 часа, и во всех экспериментальных группах не было обнаружено спонтанной активности. С другой стороны, нейроны C1 всегда были полностью безмолвными (рис. 6C).
Те же клетки снова тестировали через 24 часа, и во всех экспериментальных группах не было обнаружено спонтанной активности. С другой стороны, нейроны C1 всегда были полностью безмолвными (рис. 6C).Оценка Helix Возбудимость C1 и B2. ( A ) Типичные электрофизиологические записи нейронов C1 и B2 до и после применения 5-HT. Были измерены как спонтанная активность ( B , C ), так и реакция на шаг деполяризующего тока (0,5 нА в течение 10 секунд; D , E ). ( B ) В нейроны B2 показали значительное увеличение активности спонтанной активации только после обработки 5-HT.Через 24 часа после посева никакой активности не наблюдалось. Напротив, нейроны C1 ( C ) молчали во всех экспериментальных группах. Во время электростимуляции B2 демонстрировал аналогичную скорость возбуждения ( D ), тогда как более высокая частота возбуждения вызывалась в нейронах C1 только после применения 5-HT.
 ( E ) Сопоставимые значения были записаны через 24 часа после нанесения покрытия.
( E ) Сопоставимые значения были записаны через 24 часа после нанесения покрытия.Эти наблюдения показывают, что изолированные клетки Helix не проявляют какой-либо продолжительной спонтанной активности, вызванной применением 5-HT, в отличие от полисинаптических цепей, зарегистрированных на устройствах MEA (Рисунок 4).
Кроме того, мы также исследовали, может ли активность обработанных 5-HT цепей быть приписана изменениям в клеточной возбудимости, рассматривая скорость возбуждения одиночных клеток, индуцированную импульсом деполяризации (+ 0,5 нА в течение 10 с). Изолированные нейроны B2 показали одинаковый ответ во всех экспериментальных группах (рис. 6D). Интересно, что мы наблюдали общее увеличение возбудимости от 6 до 24 часов в нейронах C1 (рис. 6E). Двусторонний дисперсионный анализ для повторных измерений подтвердил значительный эффект времени (F (2,25) = 34.39, P <0,0001). В данном случае применение серотонина вызвало быстрое и сильное увеличение скорости возбуждения, что является статистически значимым по сравнению с контрольной и обработанной KCl группами (5-HT: 3,300 ± 0,661 пиков / с, n = 11; по сравнению с контролем: 0,357 ± 0,192 пиков / с, n = 7; по сравнению с KCl: 0,110 ± 0,023 пиков / с, n = 10; P <0,001, апостериорный тест Бонферрони ).
 Таким образом, мы можем сделать вывод, что нейроны C1 несут рецепторы, ответственные на серотонин, которые участвуют в регуляции их возбудимости без изменения их мембранного потенциала, как это наблюдается в гомологичной метацеребральной клетке Aplysia [20, 21].
Таким образом, мы можем сделать вывод, что нейроны C1 несут рецепторы, ответственные на серотонин, которые участвуют в регуляции их возбудимости без изменения их мембранного потенциала, как это наблюдается в гомологичной метацеребральной клетке Aplysia [20, 21].Во всех экспериментальных группах мы не наблюдали никаких изменений других свойств мембраны, таких как входное сопротивление, пороговый потенциал и потенциал покоя (данные не показаны). Далее мы оценили наличие изменений в кинетике потенциала действия (AP), измеряя амплитуду пика, длительность полуширины AP, время нарастания AP, время затухания AP, постгиперполяризацию и реобазу. Для каждого параметра не было обнаружено различий между обработанной и контрольной группами (данные не показаны).
Обработка 5-HT и KCl модулирует рост нейритов в схеме
HelixЧтобы лучше понять динамику возбуждения и функциональные связи, выведенные из записей MEA, была проведена параллельная оценка роста нейритов и морфологической сети.
 Мы измерили количество нейритов, соединяющих нейроны в одном кластере (внутри кластера), и среди 4 разных кластеров плотность нейритов (между кластерами), чтобы оценить плотность нейритов. Первоначально данные, измеренные с помощью нейронов C1 и B2, анализировались отдельно: мы решили включить эти значения в одну группу, поскольку их темпы роста были очень похожи друг на друга.
Мы измерили количество нейритов, соединяющих нейроны в одном кластере (внутри кластера), и среди 4 разных кластеров плотность нейритов (между кластерами), чтобы оценить плотность нейритов. Первоначально данные, измеренные с помощью нейронов C1 и B2, анализировались отдельно: мы решили включить эти значения в одну группу, поскольку их темпы роста были очень похожи друг на друга.Как показано на рисунке 7A, мы обнаружили общее и быстрое увеличение плотности нейритов внутри кластера со временем, достигающее предельного значения плато, определяемого ограниченной площадью поверхности, охватываемой каждым кластером (расстояние между двумя электродами = 200 мкм).Этот параметр зависит от лечения. Двусторонний дисперсионный анализ для повторных измерений выявил значительный эффект лечения (F (2,29) = 48,53, P <0,0001) и времени (F (2,6) = 466,7, P <0,0001) и значительное лечение временным взаимодействием (F (12,174) = 17,12, P <0,0001).
Рисунок 7 В частности, мы наблюдали статистически значимое снижение плотности внутрикластерных нейритов в цепях, обработанных 5-HT ( n = 12), которое началось с 24 часов и сохранялось в следующие моменты времени, достигая значения 0.029 ± 0,002 нейритов / мкм 2 по сравнению с 0,040 ± 0,002 нейритов / мкм 2 контрольной группы ( n = 12) через 72 часа ( P <0,001, апостериорный тест Бонферрони ) . И наоборот, нанесение раствора с высоким содержанием калия вызывало увеличение плотности нейритов с 0,051 ± 0,001 нейритов / мкм 2 , измеренных через 72 часа ( n = 8; P <0,001, апостериорный тест Бонферрони ). .
В частности, мы наблюдали статистически значимое снижение плотности внутрикластерных нейритов в цепях, обработанных 5-HT ( n = 12), которое началось с 24 часов и сохранялось в следующие моменты времени, достигая значения 0.029 ± 0,002 нейритов / мкм 2 по сравнению с 0,040 ± 0,002 нейритов / мкм 2 контрольной группы ( n = 12) через 72 часа ( P <0,001, апостериорный тест Бонферрони ) . И наоборот, нанесение раствора с высоким содержанием калия вызывало увеличение плотности нейритов с 0,051 ± 0,001 нейритов / мкм 2 , измеренных через 72 часа ( n = 8; P <0,001, апостериорный тест Бонферрони ). .Обработка KCl и 5-HT влияет на морфологическую связность Helix . ( A ) Гистограмма плотности нейритов внутри кластера. Мы обнаружили, что применение KCl увеличивало количество нейритов, соединяющих четыре клетки одного кластера.
 Наоборот, статистически значимое снижение произошло после лечения 5-HT. Аналогичные результаты были получены с учетом того, что нейриты проецируются из одного кластера в другой (межкластерная плотность). В ). В то время как 5-HT вызывал заметное снижение, менее выраженное увеличение было обнаружено в сетях, обработанных KCl.( C ) Гистограмма скорости роста нейритов, показывающая, что применяемые обработки не вызывали дефектов роста.
Наоборот, статистически значимое снижение произошло после лечения 5-HT. Аналогичные результаты были получены с учетом того, что нейриты проецируются из одного кластера в другой (межкластерная плотность). В ). В то время как 5-HT вызывал заметное снижение, менее выраженное увеличение было обнаружено в сетях, обработанных KCl.( C ) Гистограмма скорости роста нейритов, показывающая, что применяемые обработки не вызывали дефектов роста.Мы также рассмотрели межкластерную плотность нейритов как показатель нейритов дальнего действия, отражающий предполагаемые связи между четырьмя кластерами (рис. 7В). В течение первых часов развития не наблюдалось ни одного или нескольких взаимосвязанных нейритов, подтверждающих, что распространение сигнала в соответствующих записях было ограничено самим кластером. Плотность межкластерных нейритов линейно увеличивалась с 24 до 72 часов с аналогичными значениями в группе, обработанной KCl, и в контрольной группе.Расстояние между кластерами (600–1000 мкм) гарантировало непрерывное расширение нейритов без увеличения значения плато.
 Мы обнаружили, что это усиление было значительно нарушено применением серотонина (то есть через 72 часа: 0,008 ± 0,002 нейритов / мкм 2 против 0,018 ± 0,003 нейритов / мкм 2 контрольной группы; P <0,001, Бонферрони апостериорный тест ).
Мы обнаружили, что это усиление было значительно нарушено применением серотонина (то есть через 72 часа: 0,008 ± 0,002 нейритов / мкм 2 против 0,018 ± 0,003 нейритов / мкм 2 контрольной группы; P <0,001, Бонферрони апостериорный тест ).Чтобы непосредственно оценить наличие дефицита роста, вызванного однократным нанесением серотонина, мы измерили скорость удлинения нейритов в различные моменты времени.Аналогичные значения были обнаружены во всех экспериментальных группах, что позволяет предположить, что подвижность конуса роста не была затронута (рис. 7C). Таким образом, более низкая плотность нейритов может быть приписана прямому эффекту серотонина, а не нарушению роста, как это наблюдается в других моделях [22-24].
Сети Helix отображают функциональные связи во время разработкиДля исследования общей связности цепей мы проанализировали, были ли синаптические связи, обнаруженные в сложных полисинаптических цепях нейронов C1 и B2, сформированы в соответствии с предыдущими электрофизиологическими характеристиками отдельных моносинаптических пар [5] и были ли различные методы лечения (т.
 е., KCl или 5-HT) модулируют функциональные связи, принимая во внимание доказательства того, что плотность нейритов увеличивается с помощью KCl и снижается с помощью 5-HT (см. Фигуры 7A и 7B).
е., KCl или 5-HT) модулируют функциональные связи, принимая во внимание доказательства того, что плотность нейритов увеличивается с помощью KCl и снижается с помощью 5-HT (см. Фигуры 7A и 7B).На фиг. 8 показаны два примера карт функциональной связности (FC) относительно обработки KCl (фиг. 8A) и 5-HT (фиг. 8B), оцененных через 48 -й часов после нанесения покрытия. Сообщалось о двух репрезентативных кросс-корреляциях (CC) рядом с соответствующими функциональными связями: релевантное различие между обработкой KCl и 5-HT на кросс-коррелограммах — это пиковая амплитуда (примерно на один порядок величины; см., а также рисунок 9 для подробной характеристики). Карты FC были выведены из CC, оцененных среди всех активных электродов. Следуя подходу, предложенному в [25, 26], мы отсортировали все статистически значимые ссылки на основе их силы и приняли во внимание только 8 самых сильных ссылок. Таким образом, вероятно, мы рассматриваем наиболее надежные соединения, которые соответствуют физическим соединениям.
Рисунок 8 Из анализа FC мы не нашли никаких соответствующих межкластерных функциональных связей, даже если мы наблюдали некоторые дальнодействующие связи в морфологическом анализе (рис. 7B).Взаимодействие, измеренное с помощью CC, предполагает, что такие отдаленные нейроны функционально не связаны. Фактически, мы обнаружили среди межкластерных электродов: i) шумные и незначительные СС; ii) CC-пики попадают в ячейку с центром в нуле, что свидетельствует о случайной совместной активации [26].
Из анализа FC мы не нашли никаких соответствующих межкластерных функциональных связей, даже если мы наблюдали некоторые дальнодействующие связи в морфологическом анализе (рис. 7B).Взаимодействие, измеренное с помощью CC, предполагает, что такие отдаленные нейроны функционально не связаны. Фактически, мы обнаружили среди межкластерных электродов: i) шумные и незначительные СС; ii) CC-пики попадают в ячейку с центром в нуле, что свидетельствует о случайной совместной активации [26].Функциональные карты связности. Примеры карт функциональной связи, оцененных для 8 самых сильных связей в культуре, обработанной с помощью ( A ) KCl или ( B ) 5-HT.Сила соединения обозначается цветной стрелкой: от красного (сильное) до белого (слабое). Внутри карт приведены два примера кросс-коррелограмм. Масштабные линейки: A: x — ось: 90 мс, y — ось: 0,2. B: x — ось: 90 мс, y — ось: 0,01.
Рисунок 9Характеристика функциональных связей в процессе разработки.
 ( A ) Количество обнаруженных функциональных связей в культурах нейронов Helix , обработанных KCl (черная линия) и 5-HT (красная линия).( B ) Тенденция пиковых значений кросс-коррелограммы в процессе разработки (KCl черный, 5-HT красный). ( C ) Оценка синаптической задержки: в случае лечения 5-HT задержки всегда выше, чем соответствующие с KCl. ( D — E ) Схематические изображения внутриклеточных APs, зарегистрированных из пре- и постсинаптических клеток, связанных химическим ( A ) или электрическим ( B ) соединением. Первые производные сигналов показаны на нижних панелях.( F ) Гистограмма, показывающая средние синаптические задержки, измеренные в зависимости от типа соединения (химического и электрического) по сравнению с типом лечения (5-HT и KCl).
( A ) Количество обнаруженных функциональных связей в культурах нейронов Helix , обработанных KCl (черная линия) и 5-HT (красная линия).( B ) Тенденция пиковых значений кросс-коррелограммы в процессе разработки (KCl черный, 5-HT красный). ( C ) Оценка синаптической задержки: в случае лечения 5-HT задержки всегда выше, чем соответствующие с KCl. ( D — E ) Схематические изображения внутриклеточных APs, зарегистрированных из пре- и постсинаптических клеток, связанных химическим ( A ) или электрическим ( B ) соединением. Первые производные сигналов показаны на нижних панелях.( F ) Гистограмма, показывающая средние синаптические задержки, измеренные в зависимости от типа соединения (химического и электрического) по сравнению с типом лечения (5-HT и KCl).Обработка 5-HT и KCl модулирует силу и латентность синапсов.
Как и предполагалось в предыдущем разделе, есть доказательства того, что эти два лечения модулируют FC нейронных сетей Helix .
 Таким образом, чтобы охарактеризовать функциональные связи, мы оценили для всех культур и в процессе их развития прочность (т.е., пиковое значение кросс-коррелограммы) и задержка (то есть разница во времени между возникновением пика кросс-коррелограммы и нулем).
Таким образом, чтобы охарактеризовать функциональные связи, мы оценили для всех культур и в процессе их развития прочность (т.е., пиковое значение кросс-коррелограммы) и задержка (то есть разница во времени между возникновением пика кросс-коррелограммы и нулем).На рис. 9А показано количество обнаруженных соединений как функция развития сети, усредненное по количеству культур (т. Е. 3 и 2 сети на химическую обработку 5-HT и KCl, соответственно). Все обнаруженные соединения были внутрикластерными, поскольку межкластерные связи не обнаружены. Фактически это означает, что мы имели дело с 12 и 8 нефункционально связанными сетями, обработанными 5-HT и KCl соответственно.KCl вызывает увеличение количества связей по сравнению с сетями, управляемыми с помощью 5-HT, показывая результаты, аналогичные результатам измерения плотности нейритов (рис. 6А). Через 54 часа in vitro сети, обработанные KCl, достигли установившегося значения функциональных связей, тогда как в случае 5-HT наблюдалась линейная монотонная тенденция. Интересно, что KCl-опосредованные связи были сильнее, чем 5-HT (через 6 часов in vitro). Тенденция расчетной силы синапсов показала пик примерно на отметке 30 th часов (0.56 ± 0,09) и сходятся к асимптотическому значению (0,30 ± 0,003). Напротив, расчетная синаптическая сила сетей 5-HT была практически плоской с небольшими колебаниями и небольшим значением около 0,03 (на порядок меньше, чем стимуляция KCl).
Затем мы охарактеризовали функциональные связи как задержки между взаимно коррелированными электродами. Сети, обработанные KCl, показали относительно быструю синаптическую передачу (около 5 мс), которая оставалась довольно постоянной во время развития (рис. 9С).При лечении 5-HT синаптическая передача была намного медленнее: через 6 часов in vitro средняя латентность уже достигла плато, равного 20,4 ± 0,43 мс.
Из литературы известно, что нейроны Helix могут образовывать как химические, так и электрические синапсы в культуре [5]. Следовательно, мы рассматриваем возможность того, что два измеренных диапазона латентности могут быть связаны с типом соединения, в частности с синаптической задержкой. Чтобы подтвердить эту гипотезу, мы проверили изолированные пары нейронов C1-B2 и B2-B2 на наличие синаптических связей.Данные внутриклеточной записи активирующих нейронов были вычислительно преобразованы в первую производную для воспроизведения внеклеточных сигналов, полученных с помощью устройств MEA (рис. 9D и E). Эта манипуляция оправдана предыдущими исследованиями моделирования, в которых соединение нейрон-микротрансдуктор и внеклеточная записанная форма волны были математически смоделированы и охарактеризованы [27–29]. Затем мы измерили время задержки, которое произошло между двумя AP, одна в пресинаптической клетке, а другая в постсинаптическом нейроне, вызванная первым сигналом (см. Методы).Мы заметили, что электрически соединенные между собой элементы всегда срабатывают синхронно с соотношением 1: 1. Напротив, потенциалы действия, зарегистрированные от химически связанных нейронов, не всегда были связаны друг с другом. Фактически, возбуждающий постсинаптический потенциал (ВПСП), вызванный пресинаптическим возбуждением, может быть недостаточным для запуска нового потенциала действия в постсинаптическом нейроне. Например, ВПСП могут не достигать порогового потенциала или, альтернативно, могут возникать во время фазы реполяризации, когда нейрон невосприимчив к стимуляции.Эти сигналы могут привести к колебаниям мембранного потенциала, которые не могут быть обнаружены на устройствах MEA. Поэтому мы решили включить в этот анализ только всплески, которые эффективно коррелируют друг с другом. Мы обнаружили, что химические и электрические синапсы характеризуются задержками, равными 26,9 ± 2,5 мс и 5,4 ± 1,1 мс соответственно (рис. 9F). Такие значения согласуются с найденными на уровне сети (средние значения 24,7 ± 0,8 мс и 5,3 ± 0,3 мс через 48 часов) при обработке 5-HT и KCl, соответственно.
Взятые вместе, эти данные предполагают, что обработанные KCl сети Helix преимущественно связаны между собой посредством электрических синапсов, характеризующихся надежными сигналами, синхронным возбуждением и сильной связью с короткой задержкой. С другой стороны, полисинаптические цепи, в которых 5-HT применялся неоднократно, были образованы химическими связями, что объясняет более слабую связь и большую задержку. Таким образом, мы можем сделать вывод, что усиление электрической передачи по сравнению с химической передачей в цепях Helix может быть сильно повышено посредством добавления KCl, и наоборот в случае 5-HT.
Спираль из 4 пар оснований, заключающая ядро в теломеразной РНК, необходима для активности и связывания с субъединицей каталитического белка обратной транскриптазы теломеразы
РЕФЕРАТ репликация для предотвращения клеточного старения у дрожжей, людей и большинства других эукариот. Основной фермент теломеразной РНП состоит из специальной субъединицы РНК и обратной транскриптазы (теломеразная обратная транскриптаза [TERT]).Хотя большая часть 1157-нуклеотидной (нт) теломеразной РНК Saccharomyces cerevisiae, TLC1, быстро эволюционирует, центральное каталитическое ядро в значительной степени консервативно, содержащее матрицу, спираль границы матрицы, псевдоузел и спираль, включающую ядро (CEH). Здесь мы показываем, что 4 п.н. спирали, включающей ядро, необходимы для того, чтобы теломераза была активной
in vitro и поддерживала теломеры in vivo дрожжей, тогда как ΔCEH и аллели 1- и 2-п.н. не поддерживают функцию теломеразы.Используя CRISPR / дезактивированный нуклеазой Cas9 (dCas9) двухгибридный анализ CARRY (CRISPR-Assisted РНК-РНК-связывающий белок [RBP] дрожжи) для оценки связывания наших мутантных РНК CEH с TERT, мы обнаружили, что 4- РНК CEH связывается с TERT, но конструкции с более короткими CEH — нет, что согласуется с теломеразной активностью и in vivo результатами комплементации . Таким образом, CEH важен для теломеразной РНК дрожжей, потому что он необходим для связывания TERT для образования основного фермента RNP. Хотя 8 нуклеотидов, которые образуют этот 4-п.н. ствол в основании CEH, почти неизменны среди видов Saccharomyces , наши результаты с рандомизированными последовательностями и усеченными спиралями CEH предполагают, что это связывающее взаимодействие с TERT в большей степени продиктовано вторичными, чем по первичному строению.Таким образом, мы картировали важный сайт связывания в теломеразной РНК для TERT, который имеет решающее значение для формирования каталитического ядра этого биомедицинского фермента РНП.ВВЕДЕНИЕ
Теломеры — это повторяющиеся последовательности, расположенные на концах линейных эукариотических хромосом. Хотя они обеспечивают важные функции защиты генома, они не могут быть полностью скопированы ДНК-полимеразами из-за проблемы конечной репликации. Короткие теломеры запускают особую остановку клеточного цикла G 2 / M, известную как старение.Чтобы преодолеть проблему конечной репликации и предотвратить старение, большинству эукариотических организмов требуется рибонуклеопротеиновый (РНП) ферментный комплекс теломераза (1).
Основной фермент теломеразы состоит из специальной некодирующей субъединицы РНК (TLC1 в Saccharomyces cerevisiae) и белкового компонента обратной транскриптазы (обратная транскриптаза теломеразы [TERT] или Est2 в S. cerevisiae). TERT использует короткую матричную последовательность в теломеразной РНК для итеративного добавления теломерных повторов к 3′-концу хромосом (2).Вместе этих двух основных компонентов достаточно для восстановления базальной активности теломеразы in vitro (3, 4). Теломеразные РНК развиваются поразительно быстро, их размер варьируется от ~ 150 нуклеотидов (нуклеотидов) в инфузориях до> 2000 нуклеотидов у некоторых видов дрожжей, при этом даже последовательности и модели вторичной структуры из близкородственных видов одного рода демонстрируют ограниченную сохранность. Эксперименты показали, что 1157-нуклеотидная теломеразная РНК S. cerevisiae, TLC1, демонстрирует высокую степень организационной гибкости.Во-первых, TLC1 действует как гибкий каркас для связывания холоферментных белков в ферментном комплексе RNP: то есть сайты связывания для Est1, Ku и Sm 7 каждый может быть перемещен в новые места внутри РНК, поддерживая при этом функции этих субъединиц. (5–8). Во-вторых, большие части РНК необязательны для функции in vivo и in vitro (3, 8-10).
Несмотря на широкий спектр различий между теломеразными РНК, которые возникли в ходе эволюции, они явно разделяют некоторые ключевые структурные элементы в их ядре (8, 11).К ним относятся (i) шаблон, (ii) элемент границы шаблона (TBE), (iii) псевдоузел с базовыми тройками, (iv) спираль, охватывающая ядро (CEH), и (v) область необходимой связности. (ARC).
В отличие от других консервативных ядерных элементов, очень мало известно о функции спирали, охватывающей ядро. Находясь в центре ARC, CEH физически соединяет псевдоузел с матрицей, в которую входит ядро теломеразной РНК. Однако, когда CEH удаляется в контексте функциональной циклической перестановки (т.e., поддерживая целостность остова РНК через ARC) теломераза инактивирована in vitro (8), что предполагает ключевую роль спирали, включающей ядро, помимо простого включения ядра. В соответствии с необходимостью CEH, большие делеции, которые охватывают либо 5 ‘, либо 3’ сторону спирали, содержащей ядро, вызывают старение и нарушают связывание Est2 in vivo (10). Также предполагая, что CEH является TERT-связывающей областью, эта область TLC1, как было показано, физически взаимодействует с белком через gPAR-CLIP (12) (анализ, который оценивает связывание белка с РНК, но не идентифицирует конкретный белок. ).
Здесь мы приступили к исследованию структурных и функциональных требований спирали, включающей ядро, у S. cerevisiae. Мы обнаружили, что спирали длиной 4 п.н., содержащей ядро, достаточно для обеспечения функции теломеразы у дрожжей, способствуя связыванию с TERT. По-видимому, существует небольшая потребность в специфичной для последовательности спирали, включающей ядро, что указывает на то, что TERT обычно связывает двухцепочечную РНК в этой области РНК TLC1. Вместе эти данные говорят о важности спирали, заключающей ядро у дрожжей, а также помогают объяснить ее изменения в последовательности в ходе эволюции.
РЕЗУЛЬТАТЫ
Включающая ядро спираль необходима для предотвращения старения и поддержки теломеразной активности. Наши предыдущие результаты показали, что спираль, включающая ядро (CEH), необходима для активности in vitro в контексте циркулярно пермутированной теломеразной РНК аллель, включающий только каталитическое ядро, Micro-T (170) (8) (рис. 1A). Чтобы исследовать, является ли спираль, включающая ядро, существенной in vivo , и выяснить структурные требования для функционирования, мы удалили или усекли CEH в более крупном аллеле теломеразной РНК с циркулярной перестановкой, Mini-T (460).Переключение контекста с Micro-T на Mini-T необходимо, поскольку Micro-T не обладает функциями, необходимыми для функции теломеразы in vivo . Использование циклически переставленной РНК необходимо, чтобы избежать нарушения области требуемой связности (ARC) при изучении CEH, который находится в центре ARC (8). В частности, мы выбрали следующие два функциональных кольцевых пермутанта: (i) cpJ3, который имеет концы РНК между матрицей и плечом Est1, и (ii) cpTBE, который имеет концы в Ku-связывающем плече выше матрицы. граничный элемент (8) (рис.1А и Б).
Рис. 1Мутации спирали, охватывающей ядро, внутри кольцевой пермутации Mini-T (460) дрожжевой теломеразной РНК. (A) Mini-T РНК представляет собой уменьшенную, но все еще функциональную версию 1157-нуклеотидной РНК TLC1 дикого типа из S. cerevisiae (3). Красным цветом показан аллель РНК Micro-T (170), который функционирует in vitro , но не in vivo . Положение переставленных 5 ‘и 3′ концов круговых перестановок cpJ3 и cpTBE указано стрелками, а прямоугольники указывают изменения концевого плеча в этих круговых перестановках.(B) Циклическая перестановка Mini-T была выполнена путем соединения 5′- и 3’-концов обработанных форм РНК (выполненная циклической перестановкой гена, кодирующего РНК). (C) Последовательность спиральных мутантов, содержащих ядро, протестированных на рис. 2 и 3.
Мы наблюдали, что аллель cpJ3 поддерживал рост в течение 275 поколений, как показано ранее (8), тогда как аллель cpJ3ΔCEH (рис. 1C) стареет. на 75 поколений, аналогично штамму Δ tlc1 (рис. 2А). У стареющих клеток cpJ3ΔCEH теломеры были короче, чем у клеток cpJ3, на теломерах Саузерн-блоттинга (рис.2B, дорожки 13 и 14). Неспособность клеток cpJ3ΔCEH поддерживать теломеры, по-видимому, не связана с обилием РНК, поскольку мы обнаружили почти такой же уровень ΔCEH РНК с помощью Нозерн-блоттинга, что и функциональный аллель cpJ3 (рис. 2C, дорожка 7). Кроме того, мы наблюдали, что восстановленная теломераза (3) с использованием cpJ3ΔCEH была каталитически мертвой in vitro (фиг. 2D, дорожка 3). Таким образом, спираль, включающая ядро, необходима для активности и функционирования теломеразы в клетках.
Рис. 2.Минимальной спирали, включающей ядро, длиной 4 п.н. достаточно для теломеразной активности in vitro и in vivo в Mini-T (460) cpJ3.(А) Анализ старения. RAD52 -нулевые штаммы дрожжей, содержащие только указанный аллель теломеразной РНК, были серийно повторно разделены на протяжении 275 поколений. Все варианты спирали, включающие ядро cpJ3, экспрессировали из плазмид с высоким числом копий 2 мкм. Мутанты cpJ3ΔCEH, 1-bp и 2-bp стареют, в то время как мутанты длиной 4 bp и более поддерживают рост. (B) Теломерный Саузерн-блот. Жизнеспособные мутанты cpJ3 спирали, содержащие ядро, сохраняют короткие теломеры на протяжении 300 поколений. Саузерн-блоттированная геномная ДНК, расщепленная XhoI, была исследована на последовательность теломерного повтора и хромосому IV (гл.IV) контрольный регион. Обратите внимание, что количество поколений, в которых выращивали дрожжи, варьировалось, как указано, в зависимости от их жизнеспособности в жидкой культуре. Пунктирная линия представляет собой среднюю длину теломер Y ‘в Mini-T (460) в 300 поколениях при экспрессии из плазмиды 2 мкм. Наклон линии отражает миграцию Ch. IV контрольная полоса. (C) Нозерн-блоттинг, показывающий теломеразные РНК. Зрелую теломеразную РНК можно обнаружить в вариантах спирали, включающих ядро. Общую клеточную РНК зондировали либо на фрагмент, соответствующий Mini-T (460), либо на контрольную РНК из 340 нуклеотидов, NME1.Точки слева от полос указывают полноразмерные РНК, которые различаются по длине в зависимости от количества присутствующей спиральной последовательности, включающей ядро. (D) Анализ активности восстановленной теломеразы. Только жизнеспособные мутанты спирали, включающие ядро, демонстрируют детектируемую теломеразную активность in vitro . Радиоактивно меченые продукты теломеразных реакций (от +1 до +7) разделяли на 10% -ном акриламидном денатурирующем геле с помощью электрофореза. В теломеразные реакции был включен контроль восстановления и загрузки (LC).Ниже белок TERT, содержащий [ 35 S] метионин, был выделен денатурирующим электрофорезом в белковом геле, чтобы показать иммуноочистку теломеразы из системы транскрипции и трансляции in vitro .
Для дальнейшей проверки вывода о том, что спираль, содержащая ядро, важна для теломеразы дрожжей, мы исследовали функцию теломеразы, когда CEH был удален в другом кольцевом пермутанте cpTBE. Как и в случае cpJ3, мы наблюдали, что cpTBEΔCEH стареет на 75 поколений (рис.3A), что сопровождается сокращением теломер, наблюдаемым при блоттинге по Саузерну (фиг. 3B, дорожка 12). Старение снова не было связано с отсутствием накопления РНК, поскольку транскрипт cpTBEΔCEH был выявлен с помощью Нозерн-блоттинга на уровнях, аналогичных уровням других функциональных аллелей (фиг. 3C, дорожка 7). Кроме того, аллель Mini-T (460) cpTBEΔCEH был каталитически мертвым in vitro (фиг. 3D, дорожка 3).
Рис. 3.В Mini-T (460) cpTBE минимальная спираль длиной 3 п.н., включающая ядро, предотвращает старение, а одно из 4 п.н. поддерживает высокую активность фермента in vitro .(A) Штаммы дрожжей, экспрессирующие 3-п.н. аллеля Mini-T (460), демонстрируют стабильный рост небольших колоний на чашках. Дрожжевые клетки были серийно повторно взбиты до показанного планшета, как на фиг. 2. Все варианты спирали, включающей ядро, экспрессировали из плазмид 2 мкм. (B) Жизнеспособные мутанты спирали, включающие ядро, сохраняют теломеры, хотя они короче, чем Mini-T дикого типа (460). Саузерн-блоттинг выполняли, как для фиг. 2, с пунктирной линией, выровненной с миграцией контрольной полосы хромосомы IV (Ch. IV), проходящей через 2µ Mini-T дикого типа (460) в 300 поколениях.Как указано, некоторые дрожжевые клетки нельзя было вырастить в жидкой культуре до момента времени 300-го поколения. (C) Зрелая теломеразная РНК обнаруживается у всех спиральных мутантов, содержащих ядро. Нозерн-блоттинг выполняли, как для фиг. 2. Местоположение зрелой теломеразной РНК указано точкой слева от каждой полосы, предсказанной на основе приблизительного размера, который будет обработанной формой для каждого отдельного аллеля TLC1. (D) Теломеразная активность in vitro практически не обнаруживается для cpTBE с CEH 3 п.н., в то время как мутанты с 4 п.н. или более спирали, включающей ядро, демонстрируют детектируемую активность теломеразы. In vitro. Анализы теломеразной активности проводили, как показано на фиг. 2, с иммуноочищенным Est2p ниже.
Вместе независимые результаты из контекстов как cpJ3, так и cpTBE кольцевых перестановок показывают, что спираль, включающая ядро, важна для функции теломеразы in vivo и активности основного фермента RNP in vitro .
Включающей ядро спирали длиной 4 п.н. достаточно для поддержки активности теломеразы. Учитывая функциональную необходимость спирали, включающей ядро, мы решили определить, какие особенности ее структуры необходимы.Мы начали с добавления обратно пары оснований нативное ядро-проксимальное основание одну за другой (рис. 1С). Этот анализ показал, что всего 4 п.н. нативной включающей ядро спиральной последовательности в cpJ3 поддерживают функцию теломеразы в предотвращении старения (Fig. 2B) и теломеразную активность с TERT in vitro (Fig. 2D, lane 6). CEH размером 3 п.н. в cpTBE вызывал промежуточный фенотип, едва позволяя клеткам избежать старения (и вызывая медленный рост выживших) (рис. 3A), и без четко заметной активности теломеразы (рис.3Д, переулок 6). Напротив, спирали, содержащие ядро из 1 и 2 п.н. в cpJ3 или cpTBE, не поддерживают какую-либо функцию теломеразы in vitro или in vivo (Fig. 2 и 3). Для этих аллелей, вероятно, образование пары оснований не стабильно. Таким образом, наши данные показывают, что для существенной функции спирали, охватывающей ядро, требуется минимум 4 п.н.
Добавление назад большего количества нативной спирали, включающей ядро, также поддерживало активность теломеразы in vivo и in vitro , хотя без заметного увеличения активности по более короткой спирали из 4 пар оснований (рис.2 и 3). В частности, мы добавили либо 23 нуклеотида, что соответствует эндогенной спирали, содержащей ядро, присутствующей в Micro-T (170), либо 45 нуклеотидов. Обе эти включающие ядро спирали поддерживали рост клеток без признаков старения в двух циклически переставленных контекстах Mini-T (рис. 2A и 3A), стабильно короткие теломеры (рис. 2B, дорожки с 21 по 24 и рис. 3B, дорожки 18-20) и восстановленной активности теломеразы (фиг. 2D, дорожки 7 и 8, и фиг. 3D, дорожки 8 и 9).
Родная проксимальная к ядру последовательность спирали, вмещающей ядро, не является необходимой для функционирования.Чтобы определить, важна ли последовательность нативной последовательности спирали, включающей ядро, мы протестировали неродные пары оснований. Интересно, что рандомизированная по последовательности спираль из 4 п.н. (рис. 1C [с 5′-сторонним GAAU, а не CUGA у дикого типа]) была способна поддерживать слабую теломеразную активность в контексте cpTBE, оба in vivo (рис. . 3A и B, дорожки с 21 по 23) и in vitro (фиг. 3D, дорожка 10). Та же спираль из 4 п.н. со случайной последовательностью в контексте cpJ3 не была достаточно функциональной in vivo , чтобы предотвратить старение (рис.2A), хотя он обладал слабо заметной активностью in vitro (фиг. 2D, дорожка 9). Более длинная случайная спираль длиной 16 п.о. (рис. 1С) в cpTBE показала функцию теломеразы, аналогичную функции случайной спирали из 4 п.о. (рис. 3D, дорожка 11). Эти результаты предполагают, что эндогенная последовательность спирали, содержащей ядро, играет некритическую, но также и несуществующую роль в ее функции.
Для дальнейшего тестирования структурных и функциональных требований спирали, включающей ядро, мы исследовали серию делеций в Mini-T с некруглыми перестановками (460).Если конкретная последовательность или расположение выпуклостей в спирали, включающей ядро, является критическим для функции, то удаление этих областей должно отменять функцию. Сначала мы удалили 4 п.н., ближайшие к сердцевине (Δ8 на рис. 4A). Это те же 4 п.н., которые поддерживают функцию в cpJ3 (рис. 2). Этот аллель усечения Δ8 CEH заставляет спираль, заключающую ядро, теперь начинаться с асимметричного 3-nt выпуклости, увеличивая длину соединений J4 и J1 с обеих сторон спирали, за которыми следуют 3 bp (Fig. 4A).Эта делеция Δ8 поддерживала рост в течение 275 поколений (фиг. 4B), хотя теломеры у этих мутантов были короче, чем у Mini-T (460) клеток дикого типа (фиг. 4C, дорожки 8 и 9 по сравнению с дорожками 10 и 11). Более короткие теломеры в Mini-T (460) Δ8, по-видимому, не связаны с более низкой РНК (рис. 4D, дорожка 5 по сравнению с дорожкой 6). Однако делеция 8 нуклеотидов действительно частично снижает активность основного фермента теломеразы in vitro (фиг. 4E, дорожка 1 по сравнению с полосой 2).
Рис. 4Ближайшие к ядру области спирали, включающей ядро, не обязательны для теломеразной функции in vitro и in vivo .(A) Схема, показывающая проверенные делеции нуклеотидов нативного ядра спирали. На вставке показана последовательность из 4 п.н., вставленная на проксимальной стороне ядра в аллеле +4 п.н. (B) Мутации, которые изменяют длину и природу проксимальной области ядра спирали, включающей ядро, предотвращают старение Mini-T (460). Дрожжевые клетки пересеивали на твердую среду через 275 поколений. Все делеционные или инсерционные мутанты экспрессировали из плазмид с высоким числом копий 2 мкм. (C) Теломеры короче Mini-T (460), когда спираль, охватывающая ядро, усечена или расширена.Геномную ДНК подвергали саузерн-блоттингу, как показано на фиг. 2. Пунктирная линия представляет длину теломер Mini-T (460) дикого типа в 300 поколениях при уровнях экспрессии 2 мкм для сравнения. (D) Теломеразная РНК экспрессируется от всех протестированных мутантов. Нозерн-блоты выполняли, как на фиг. 2, с точками, указывающими положение зрелой РНК в геле. (E) Делеции и вставки вызывают небольшие дефекты в активности теломеразы in vitro . Анализы активности теломеразы были завершены, как показано на рис.2.Иммуноочищенный радиоактивно меченный белок ProA-Est2 показан ниже.
Более крупные делеции спирали, включающей ядро, также поддерживали активность теломеразы. Мы удалили 11 нуклеотидов [соответствующие нативным нуклеотидам, присутствующим в Micro-T (170)], 19 нуклеотидов и 39 нуклеотидов (рис. 4A). Все эти делеции приводят к различным спиральным структурам, включающим ядро, около ядра, но каждый из этих аллелей поддерживает теломеразную активность in vivo и in vitro (фиг. 4B и E).Укороченные теломеры (Рис. 4C), поддерживаемые этими аллелями, по-видимому, не связаны с недостаточным уровнем РНК (Рис. 4D).
Наконец, мы протестировали вставку дополнительных 4 п.н. на проксимальном к ядру конце спирали, включающей ядро (рис. 4A). Эта вставка (+4 п.н.) предотвращала старение через 275 поколений (рис. 4B). Подобно укорочению CEH, вставка +4 п.н. также вызвала укорочение теломер по сравнению с Mini-T дикого типа (460) (рис. 4C, дорожки 18 и 19 по сравнению с дорожками 8 и 9), что не связано с понижением теломеразной РНК. выражение (рис.4D, дорожка 5 против дорожки 10). Вставка +4 п.н. также поддерживает активность теломеразы in vitro (фиг. 4E, дорожка 6).
Важно отметить, что все 5 этих аллелей (Δ8, Δ11, Δ19, Δ39 и +4 п.н.) генерируют спиральную последовательность, включающую ядро, примыкающую к каталитическому ядру, которое отличается от дикого типа, но все эти аллели хорошо функционируют как in vivo , так и in vitro . Это дополнительно подтверждает вывод, что нативная проксимальная к ядру последовательность спирали, включающей ядро, не является существенной для функции теломеразы.
Спираль, включающая ядро, необходима для связывания теломеразной РНК с TERT. Какова механистическая роль спирали, включающей ядро, в функции теломеразной РНП? Наши результаты показывают, что CEH необходим как для действия теломеразы in vivo, и in vitro, так и для действия теломеразы in vitro — таким образом, CEH необходим для фундаментальной активности основного фермента теломеразы. Поскольку основной фермент состоит из РНК TLC1 и субъединицы каталитического белка TERT, экономное объяснение вклада CEH в функцию фермента состоит в том, что РНК просто требуется, чтобы РНК связалась с TERT для сборки основного фермента.
Чтобы проверить гипотезу о том, что CEH является ключевым сайтом связывания для TERT в теломеразной РНК, мы использовали in vivo CRISPR-ассистированную РНК-РНК-связывающий белок (RBP) дрожжевой (CARRY) взаимодействие двухгибридной РНК-белка проба (13). В этом методе используется каталитически неактивный CRISPR / dCas9 (Cas9, дезактивированный нуклеазой) для связывания интересующей РНК выше репортерных генов в дрожжах, так что если интересующая РНК связывается с белком (слитым с доменом активации транскрипции Gal4 [GAD]), Взаимодействие связывания РНК с белком можно обнаружить по экспрессии репортерного гена HIS3 , что позволяет дрожжам расти в отсутствие гистидина (рис.5А) (13). Во-первых, мы проверили, связывается ли Micro-T (170) с TERT в двухгибридной системе CARRY. Действительно, конструкция Micro-T (170) обеспечивала значительный рост на среде без гистидина (в ~ 1000 раз больше, чем в отрицательном контроле [рис. 5B, второй ряд]), что указывает на сильную активацию репортерного гена на основе связывания с GAD-Est2 ( ТЕРТ). Кроме того, циркулярно пермутированный Micro-T (cpTBE) также связывался с GAD-TERT по меньшей мере так же хорошо, как и неперестановленный Micro-T дикого типа (фиг. 5B, ряд 3). Однако, когда мы удалили CEH из этого аллеля cpTBE, произошла полная потеря связывания TERT (рис.5B, сравните строки 3 и 4). Micro-T cpTBE с 1-, 2- или 3-п.н. CEH не связывает TERT, но 4-п.н. CEH связывает, что согласуется с характеристиками этих аллелей в функции теломеразы in vivo и in vitro (рис. 2 и 3). Мы также протестировали связывание случайными аллелями CEH из 4 п.н. и 23 н., И они показали небольшую активацию HIS3 или ее отсутствие. Учитывая, что эти РНК должны быть способны связываться с TERT, по крайней мере, до некоторой степени, чтобы поддерживать активность теломеразы, предположительно эти аллели связываются с TERT: i.е. слишком слабо, чтобы двухгибридная система CARRY могла обнаружить (константа диссоциации [ K d ] ≥∼1 мкМ) (13), но все же достаточна для обеспечения сборки и функционирования теломеразы, как показано на рис. 2 и 3. В целом мы заключаем, что CEH необходим для связывания с TERT и что 4 п.н. достаточно для этого критического взаимодействия в ядре теломеразной RNP.
Рис. 5Связывание TERT с теломеразной РНК нарушается спиралью, включающей ядро, короче 4 п.н. (A) Схема двухгибридной системы дрожжей РНК-RBP с помощью CRISPR (CARRY) (13).Различные мутанты ядра РНК TLC1 были слиты с sgRNA CRISPR, которая была привязана к промотору репортерного гена HIS3 с помощью дезактивированного нуклеазой Cas9 (dCas9). Также экспрессировалось слияние белка Est2 с доменом активации транскрипции (GAD) Gal4, и активация репортерного гена HIS3 использовалась в качестве меры связывания между Est2 и ядром РНК TLC1. (B) Для связывания Micro-T (170) с TERT в двухгибридной системе CARRY требуется спираль из 4 пар оснований, включающая ядро.Экспрессию HIS3 анализировали путем выращивания клеток до насыщения в жидкой культуре, выполнения шести 10-кратных серийных разведений и нанесения этих клеток в виде пятен на твердую среду с гистидином или без него. В столбце GAD-Est2 «-» указывает на экспрессию GAD, которая не слит с Est2, а «+» указывает на экспрессию слитого белка GAD-Est2. Точно так же «-» в столбце sgRNA – Micro-T указывает на экспрессию sgRNA, которая не слита с Micro-T.
ОБСУЖДЕНИЕ
Многосубъединичный фермент не может быть активным, если его основные компоненты не собираются.Несмотря на этот основной критерий функции, относительно мало известно об интерфейсах, которые регулируют связывание между субъединицами в сердце биомедицинского фермента теломеразы RNP. Здесь мы продемонстрировали, что спираль теломеразной РНК, включающая ядро, необходима для связывания с субъединицей каталитического белка TERT в дрожжах.
Для изучения спирали, включающей ядро, которая находится в середине области необходимого соединения, мы переместили концы теломеразной РНК подальше от ARC, чтобы не нарушать ее в наших мутантных аллелях CEH.Таким образом, мы циклически переставляли РНК TLC1, что позволило нам удалить CEH без нарушения непрерывности РНК через ARC. Этот подход предоставил нам возможность анализировать ARC от функции CEH, показывая, что CEH важен для функции теломеразной RNP как in vivo, и in vitro, , что согласуется с тем, что он необходим для связывания с TERT. Кроме того, наши выводы основаны на данных, полученных при изучении CEH в двух независимых контекстах аллелей теломеразной РНК с циклической перестановкой (рис.2 и 3). Одна из круговых перестановок имеет концы РНК, перемещенные к дистальной части элемента границы шаблона, cpTBE, а другая — внутрь соединения в центральном концентраторе между шаблоном и псевдоузлом, cpJ3 (Fig. 1A). В обоих этих разных условиях мы обнаружили, что CEH из 4 пар оснований является достаточным для функции теломеразы. Наличие меньшего количества пар оснований не позволяет CEH функционировать, и вполне вероятно, что они также нестабильно образуют спираль, что согласуется с парным элементом вторичной структуры, необходимым в этом положении дрожжевой теломеразной РНК для ее функционирования.
Что касается любой функциональной важности последовательности CEH, наши результаты, полученные на основе рандомизированных последовательностей, усеченных аллелей и аллелей с расширенной спиралью, предоставляют убедительные доказательства того, что включающие ядро спирали с различными последовательностями (6 различных вариантов) обеспечивают по крайней мере базовую активность теломеразы. . Функциональность CEH в этих аллелях была, несмотря на сенсибилизированный контекст тестирования, в миниатюрной РНК TLC1, которая, даже если в противном случае имеет последовательность дикого типа, поддерживает довольно короткие теломеры. Мы пришли к выводу из результатов, что последовательность CEH, хотя и вносит некоторый вклад в функцию теломеразной РНК, не является существенной и, следовательно, вторичная структура CEH более важна, чем первичная структура.
Спираль, включающая ядро, является консервативным свойством теломеразных РНК помимо дрожжевых, она также присутствует в человеческих, реснитчатых и большинстве других теломеразных РНК, известных на сегодняшний день. 4 п.н., которые мы считаем критическими для CEH S. cerevisiae, по существу инвариантны среди видов Saccharomyces (5, 14), причем наиболее близкий к ядру GC изменяется на G · U пару у одного штамма Saccharomyces mikatae ( 8), что согласуется с нашими результатами, предполагающими, что вторичная структура более важна, чем последовательность.У мерцательного простейшего Tetrahymena thermophila разрушение спирали, содержащей ядро, снижает активность на 95-99%, что указывает на важность этой структуры у отдаленно родственных видов (15). У людей, в то время как усечение 5′-конца все еще разрешает функциональную теломеразу, определение границ шаблона нарушено (16). Любопытно, что у теломеразных РНК грызунов свой 5′-конец расположен всего на 2-5 нуклеотидов выше матрицы (17, 18), и поэтому, по-видимому, эти нуклеотиды не могут спариваться с образованием CEH.У этих видов было высказано предположение, что TERT просто использует обратную транскрипцию стока, так как эти РНК также лишены элемента границы матрицы (17). Таким образом, РНК грызунов отличаются от РНК всех других известных теломераз. Стоит также отметить, что элемент границы матрицы и спираль, включающая ядро, по-видимому, объединены в один парный элемент в теломеразной РНК человека (11, 16). Соответственно, CEH у дрожжей может быть важным участком связывания TERT, не выполняя ортологическую функцию у некоторых других видов.Вероятно, что различия в том, как взаимодействуют РНК и TERT, связаны с быстрой эволюцией RNP.
Наши результаты показывают, что связывание TERT с TLC1 не требует строго определенной спиральной последовательности, а скорее, по-видимому, больше продиктовано вторичной структурой. Этот вывод подтверждается филогенетикой и тем фактом, что 6 различных парных последовательностей, которые мы тестировали вместо CEH дикого типа, обеспечивали важную функцию in vivo, и , in vitro, (рис.2-4). Двухгибридный анализ CARRY не смог обнаружить связывание с TERT для случайных 4-нуклеотидных CEH и обнаружил слабое связывание для 23-нуклеотидных CEH (фиг. 5B). Это говорит о том, что аффинность связывания TERT для случайных и 23-нуклеотидных РНК CEH находится примерно на пороговом уровне для двухгибридного анализа CARRY и согласуется со сниженной in vitro теломеразной активностью , поддерживаемой этими аллелями, по сравнению с CEH длиной 4 п.н. (Рис. 2D, дорожка 9 и Рис. 3D, дорожки 8 и 10). В целом, наши данные предполагают, что TERT связывается непосредственно со спиралью, содержащей ядро теломеразной РНК дрожжей.Тем не менее вполне возможно, что CEH также или вместо этого способствует связыванию TERT в другом месте РНК. Вполне вероятно, что CEH не единственный сайт связывания для TERT в TLC1, особенно учитывая сложную динамику, необходимую теломеразе для итеративного повторного использования матрицы во время повторной процессивности добавления. Что касается того, какой из других консервативных элементов вторичной структуры в дрожжевой теломеразной РНК также может вступать в связывающие контакты с TERT, некоторые из лучших вариантов включают псевдоузел, матричный граничный элемент (TBE) и / или ядра соединений (J1, J2, и J4).Предыдущее исследование показало, что укорочение псевдоузла приводит к снижению связывания TERT с Micro-T, но что область тройной спирали не участвует в связывании (9). Хотя самый простой способ объяснить эти результаты состоит в том, что TERT связывается с псевдоузлом, возможно, что проверенные усечения псевдоузла также дестабилизировали CEH, который расположен всего на 3’из нескольких аллелей псевдоузлов, наиболее дефектных по связыванию. Что касается связывания TERT с центральными соединениями, мы ранее показали, что соединение 1 необязательно для базальной функции, но соединение 4 длиной 2 н. Между CEH и псевдоузлом (рис.1A), необходим для активности теломеразы в ARC (8).
Кристаллическая структура 3 Å РНК-связывающего домена Tetrahymena TERT в комплексе со спиралью TBE показывает, что белок устанавливает прямые контакты с неспаренными нуклеотидами в основании этой спирали (19). Криоэлектронная микроскопия (крио-ЭМ) структуры холоэнзима Tetrahymena (20) толщиной 4,8 Å показывает, что TERT контактирует с РНК по периферии комплекса РНП основного фермента, где есть пространство, которое может позволить множественное связывание TERT интерфейсов у эволюционно далеких видов дрожжей и, возможно, даже у инфузорий.Объединение результатов дрожжей и инфузорий указывает на то, что дрожжевой TERT может также связываться с CEH-фланкирующими соединениями в TLC1. Однако контакты J1 не являются абсолютно необходимыми для функции теломеразы, так как это соединение не является существенным для базальной активности (8). С точки зрения крио-ЭМ-структуры теломеразы 10,2-Å (21), спираль P1b (т.е. «CEH» в теломеразной РНК человека, hTR) сопоставляется с смоделированным доменом связывания РНК Tribolium TERT, так что он очень хорошо может представлять ключевой интерфейс связывания для hTERT в человеческом коровом ферменте, особенно если рассматривать связывание инфузорий TERT-RBD со спиралью инфузорий TBE.
Теломераза — это уникальная обратная транскриптаза, поскольку она, в отличие от вирусных обратных транскриптаз, многократно повторно использует короткую матрицу РНК, присущую ферменту РНП. Это повторное использование матрицы, необходимое для процессивной активности, включает временное нарушение спаривания оснований РНК с ДНК-субстратом фермента, в то время как РНП остается связанным с концом хромосомы через другое связывание теломер-фермент. Во время этого многогранного взаимодействия фермента с теломерной ДНК через каталитический цикл также должно поддерживаться взаимодействие теломеразная РНК-TERT.Это динамическое взаимодействие должно требовать многочастичного связывающего взаимодействия между теломеразной РНК и TERT. Теломераза, конечно, взаимодействует с матрицей через свой активный сайт, но предположительно взаимодействие связывания с наивысшим сродством между РНК и TERT находится вне области матрицы РНК, чтобы обеспечить соединение, которое поддерживает целостность ядра РНП во время катализа. Может быть важным, чтобы этот сайт связывания TERT в РНК находился дистальнее по отношению к каталитическому сайту TERT-матрице РНК РНП, чтобы избежать стерического затруднения сайта связывания повторному процессу связывания, расширения и диссоциации от теломерной ДНК. субстрат.В частности, как обсуждалось выше, мы предполагаем, что TERT наиболее заметно связывается с нуклеотидами теломеразной РНК в других местах вокруг центрального концентратора РНК от матрицы в модели вторичной структуры (рис. 6). Это подтверждается нашими текущими результатами и результатами, опубликованными в различных лабораториях, изучающих дрожжи и другие организмы (9, 11, 19, 20, 22), в том числе нашим предыдущим выводом о том, что разрыв основной цепи РНК в области требуемой связности (ARC) соединяет спираль, включающую ядро, с матрицей, устраняет активность фермента ядра теломеразы (8).Таким образом, как показано на рис. 6 для случая дрожжей, мы предполагаем, что существует центральная тема, возникающая среди теломераз: критическая спираль в хабе теломеразных РНК представляет собой важный TERT-связывающий плацдарм, который удерживает основной фермент РНП. вместе во время раундов РНК-матричного синтеза ДНК.
Рис. 6. ВзаимодействияРНК-TERT и их функциональное значение для удлинения теломер с помощью фермента ядра теломеразы РНП дрожжей. Обозначены спираль, охватывающая ядро, и ее связь с TERT (серый цвет).Мы предполагаем, что связывание TERT с областью (ами), соединенной с шаблоном областью требуемой связи (темно-серый), позволяет TERT оставаться связанным с TLC1. Это связывающее взаимодействие, вероятно, будет важным во время уникального каталитического цикла обратной транскрипции теломеразы, который основан на внутренней матрице РНК, которая требует, чтобы активный сайт TERT диссоциировал от матрицы и вновь синтезированной ДНК во время повторной процессивности добавления in vivo .
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы дрожжей и плазмиды.Все in vivo анализов на функцию теломеразы использовали штамм дрожжей yVL009 ( MAT a tlc1 Δ :: LEU2 rad52 -Δ :: LYS ura3-52 lys2-801 ade2-101 trp-1 904 Δ 1 his3 -Δ 200 leu2 -Δ cir + pSD120 / p TLC1-URA3-CEN ) (22). Все новые мутанты получали с помощью ПЦР и субклонировали в вектор pRS424 с меткой 2μ TRP1 для in vivo анализов или вектор на основе pUC19 для in vitro анализов .
Анализы старения. Штаммы дрожжей yVL1009 трансформировали плазмидой CEN с меткой TRP1 или 2 мкм стандартными методами с ацетатом лития. Трансформанты отбирали на среде без урацила и триптофана, а затем наносили штрихами на среду без триптофана, содержащую 5-фтороротовую кислоту (5-FOA), для контрселекции на покрывающую плазмиду TLC1 с меткой URA3 дикого типа. Дублированные колонии дрожжей, содержащие только трансформированную плазмиду, затем последовательно наносили штрихами 10 раз на среду без триптофана при 30 ° C.
Саузерн-блоттинг. Для определения длины теломер проводили Саузерн-блоттинг, как описано ранее (6). Вкратце, дрожжевые клетки культивировали в жидкой среде без триптофана при 30 ° C и выделяли геномную ДНК (набор Puregene; Qiagen). Очищенную геномную ДНК расщепляли в течение ночи с помощью XhoI, а затем подвергали электрофорезу через 1,1% агарозный гель при 70 В в течение 17 часов. Затем фрагменты ДНК переносили на мембрану Hybond N + (GE Healthcare) под действием капилляров, сшивали с помощью УФ-излучения и инкубировали с радиоактивно меченными зондами для теломерной ДНК и области хромосомы IV.Кляксы получали с помощью тепловизора с регулируемым режимом Typhoon 9410.
Нозерн-блоттинг. Суммарную РНК выделяли методом экстракции горячим фенолом из жидких культур дрожжей, выращенных в логарифмической фазе в отсутствие триптофана. Тридцать микрограмм общей клеточной РНК подвергали электрофорезу через гель мочевины 4% полиакриламид – 1 × трис-борат-ЭДТА – 7 М при 35 Вт в течение ~ 3 часов. Разделенные РНК электропереносили на мембрану Hybond N + (GE Healthcare) и подвергали сшивке УФ. Мембрану зондировали 1 × 10 7 имп / мин фрагмента StuI-NsiI Mini-T (460) и 1 × 10 5 имп / мин контрольной РНК, NMEI .Кляксы получали с помощью тепловизора с регулируемым режимом Typhoon 9410.
Анализ активности восстановленной теломеразы. Теломеразу получали с использованием сопряженной системы транскрипции и трансляции in vitro , как описано ранее (3). Вкратце, ДНК-матрицы для ProA-Est2 TERT и теломеразной РНК инкубировали в системе лизата ретикулоцитов кролика, включающей [ 35 S] метионин, в течение 90 мин. Затем теломеразу подвергали иммуноочистке с использованием гранул IgG-сефарозы (GE Healthcare). Очищенную теломеразу инкубировали с олигонуклеотидом теломерной ДНК (DZ428: 5′-GGTGTGGTGTGGG-3 ′), 5 ′ γ- 32 P-меченным внутренним контролем восстановления и загрузки, [α- 32 P] dTTP и 1 мМ каждый немеченый dATP, dCTP и dGTP в стандартном буфере активности теломеразы in vitro .Собранные реакционные смеси инкубировали в течение 10 мин при 26 ° C, затем реакции останавливали добавлением ацетата аммония и осаждением этанола. Продукты ресуспендировали в загрузочном красителе формамид и кипятили при 95 ° C в течение 5 мин. Образцы подвергали электрофорезу через гель мочевины 10% полиакриламид – 1 × трис-борат-ЭДТА – 7 М в течение 75 мин при 90 Вт, а затем сушили на бумаге Whatman и экспонировали на экране фосфорного сканера. Визуализация проводилась с помощью тепловизора с переменным режимом Typhoon 9410. В качестве контроля загрузки и восстановления во время очистки восстановленной теломеразы (рис.2D, 3D и 4E), 2,5 мл теломеразы ресуспендировали в буфере для образцов Лэммли, кипятили при 95 ° C в течение 5 минут и разделяли на 7,5% геле Mini-PROTEAN TGX (Bio-Rad). Гель переносили на бумагу Whatman, сушили и отображали с помощью формирователя изображений с регулируемым режимом Typhoon 9410.
CARRY двухгибридные анализы РНК-RBP. Двухгибридные анализы CARRY проводили, как описано ранее (13). Вкратце, штамм CARRYeast-1a [ MAT a his3 Δ 200 trp1-901 ade2 lys2 : 🙁 4LexAop-HIS3 ) ura3 : 🙁 8LexAop- 8LexAop- : 🙁 KanMX6_dCas9 )] трансформировали плазмидами слияния с одной направляющей РНК (sgRNA) и слияния GAD с векторными каркасами из pCARRY2 (13) с меткой TRP1 и с pGAD424 с меткой LEU2 (23) соответственно.Трансформанты выращивали до насыщения в синтетической жидкой культуральной среде без триптофана и лейцина. Каждой культуры делали шесть 10-кратных серийных разведений, и 5 мкл каждого разведения, а также неразбавленную культуру, наносили пипеткой на твердые –Trp –Leu и –Trp –Leu –His минимальные среды. Клетки инкубировали 3 дня при 30 ° C и фотографировали.
БЛАГОДАРНОСТИ
Исследования, представленные в этой публикации, были поддержаны Национальным институтом общих медицинских наук Национальных институтов здравоохранения в рамках присуждения №R01GM118757 по D.C.Z.
Заявка на патент PCT / US2018 / 029329 на двухгибридное изобретение CARRY была подана авторами D.C.Z. и E.P.H. и Университет Джона Хопкинса.
СНОСКИ
- Получено 29 мая 2020 г.
- Возвращено на модификацию 18 июля 2020 г.
- Принято 30 сентября 2020 г.
- Принято рукопись размещена в Интернете 12 октября 2020 г.
- Copyright © 2020 Mefford et al.
Противовирусная активность кольцевой тройной спирали, формирующей олигонуклеотидную РНК в отношении репликации вируса инфекционного перитонита кошек, in vitro
Инфекционный перитонит кошек (FIP) является тяжелым смертельным заболеванием с усиленным иммунитетом в популяции кошек.Это вызвано вирусом FIP (FIPV), вирулентным мутантным штаммом кишечного коронавируса кошек (FECV). Современные методы лечения и профилактики неэффективны. Антивирусные свойства in vitro пяти кольцевых трехспиральных олигонуклеотидных (TFO) РНК (от TFO1 до TFO5), которые нацелены на различные области генома вирулентного коронавируса кошек (FCoV) штамма FIPV WSU 79-1146, были протестированы в FIPV- инфицированные клетки почки кошек Crandell-Rees (CRFK). Результаты RT-qPCR показали, что кольцевые РНК TFO, за исключением TFO2, ингибируют репликацию FIPV, при этом число копий вирусного генома значительно уменьшилось в 5 раз, логарифм 10 с 10 14 в клетках, инокулированных вирусом, до 10 9 в клетках, трансфицированных кольцевыми РНК TFO.Кроме того, связывание кольцевой РНК TFO с целевым сегментом вирусного генома также подтверждали с помощью анализа сдвига электрофоретической подвижности. Сила кинетики связывания между РНК TFO и их целевыми областями была продемонстрирована с помощью анализа NanoITC. В заключение можно сказать, что кольцевые TFO имеют потенциал для дальнейшего развития в качестве противовирусных агентов против инфекции FIPV.
1. Введение
Вирус инфекционного перитонита кошек (FIPV) представляет собой оболочечный вирус с несегментированным положительно смысловым одноцепочечным геномом РНК.FIPV сгруппирован как коронавирус кошек (FCoV) в семействе Coronaviridae. FCoV подразделяется на два биотипа, а именно: энтерический коронавирус кошек (FECV), широко распространенный кишечный биотип FCoV, и FIPV, вирулентный биотип FCoV [1]. Взаимосвязь между этими двумя биотипами до сих пор остается неясной. Были предложены две гипотезы: (i) теория внутренней мутации и (ii) распространенная теория высокой-низкой вирулентности. Теория внутренней мутации утверждает, что развитие FIP происходит из-за воздействия на кошку вариантов FCoV, которые были мутированы за счет приобретения способности реплицироваться в макрофагах [2], в то время как теория циркулирующих высоко-вирулентных и низковирулентных вирусов объясняет существование как отличительные патогенные, так и доброкачественные линии вирусов в популяции кошек [3].
Исследование показало, что около 40–80% кошек выявляются с выделением FECV с фекалиями [4]. Около 12% этих кошек с положительной реакцией на FECV заболевают иммуноопосредованным смертельным заболеванием FIP [4]. Распространенность FIP среди кошачьих связана с постоянными циклами инфицирования и повторного инфицирования FECV и неразличимыми клиническими симптомами у инфицированных кошек FECV на ранней стадии до прогрессирующего развития FIPV.
Вакцинация против FIPV ослабленным, чувствительным к температуре штаммом FIPV типа II индуцирует низкий титр антител у котят, которые не подвергались воздействию FCoV.Однако существуют значительные разногласия по поводу безопасности и эффективности этой вакцины, поскольку вакцина содержит штамм 2 типа, тогда как вирусы типа 1 более распространены в этой области [4]. Кроме того, антитела против FIPV не защищают инфицированных кошек, но усиливают инфицирование моноцитов и макрофагов с помощью механизма, известного как антитело-зависимое усиление [1]. Помимо вакцин, несколько противовирусных препаратов, таких как рибавирин, интерфероны и иммунодепрессанты, использовались для лечения кошек, инфицированных FIPV, главным образом для подавления воспалительного и вредного иммунного ответа [5–8].Однако эти методы лечения оказались неэффективными. Следовательно, все еще существует значительная неудовлетворенная потребность в медицине в разработке эффективных методов лечения и профилактики инфекции FIPV.
Тройной спиралиобразующий олигонуклеотид (TFO) определяется как гомопиримидиновые олигонуклеотиды, которые могут образовывать специфичную для последовательности тройную спираль за счет связей Хугстина с большой бороздой комплементарного участка гомопиримидин-гомопурин в дуплексной ДНК [9]. Кроме того, двойная спиральная РНК или гибриды ДНК-РНК могут быть нацелены в качестве матрицы для образования тройной спирали, как только будет определен состав цепи по стабильности тройных спиральных комплексов [10].Следовательно, TFO использовался для предотвращения экспрессии генов путем ингибирования транскрипции вирусных генов или онкогенов [11–16]. Основная цель этого исследования — разработать и оценить противовирусные свойства in vitro кольцевых РНК TFO против репликации FIPV.
2. Материалы и методы
2.1. Клетка и вирус
Вирус инфекционного перитонита кошек (FIPV) серотипа II штамм WSU 79–1146 (номер АТСС VR-1777) выращивали в клетках CRFK. Из рабочего материала готовили серийное 10-кратное разведение FIPV.Конфлюэнтный 96-луночный планшет инокулировали 100 мкл мкл каждого разведения вируса на лунку. Планшет инкубировали в увлажненном инкубаторе при 37 ° C, 5% CO 2 . Наблюдалось развитие цитопатических эффектов (ЦПЭ). Результаты были зарегистрированы через 72 часа, и инфекционная доза 50 для культуры ткани вируса (TCID 50 ) была рассчитана с использованием метода Рида и Мюнха [17].
2.2. Приготовление кольцевой тройной спирали, формирующей олигонуклеотидную РНК
Тройную спираль, образующую олигонуклеотиды (TFO), были сконструированы на основе геномной последовательности штамма WSU 79–1146 серотипа II FIPV (номер доступа: AY994055) [18].Были сконструированы TFO, которые специфически нацелены на разные области генома FIPV, и один неродственный TFO (Таблица 1). Специфичность TFO была определена с помощью поиска BLAST в базе данных NCBI. Разработанные линейные TFO были синтезированы Dharmacon Research (США), при этом 5′- и 3′-концы линейных TFO были модифицированы фосфатной (PO 4 ) группой и гидроксидной (OH) группой соответственно. Эти модификации были необходимы для циркуляризации линейных TFO. Процесс циркуляризации с использованием РНК-лигазы 1 Т4 (оцРНК-лигаза) (New England Biolabs Inc., Англия), проводили согласно протоколу производителя. После лигирования кольцевые РНК TFO выделяли осаждением этанолом, и чистоту кольцевых РНК TFO измеряли с помощью спектрофотометра.
TFO Последовательности TFO Целевая последовательность * Целевой ген и положение A GAA C GAAA
50 ′ tataa ctcttcttttacttt aacta 3 ′ 5′UTR и 36–50 TFO2 AAAAGGAAAA
C C
C C
AAAAGGAAAAactag 90atag UTR и 29335–29344TFO3 GGAUAAGAGGAA
C C
C C
GGACAAGAGGAA5 ′ ttaaa cctgttga846 ‘8 cctgttga846 ′
AAAGAGGGGAGAA
C C
C C
AA AGAGGUGAGAA5 ‘cagga tttctccactctt agttc 3′ ORF1a / 1b и 7399–7411 TFO5 AAAGGGAAGAAAGA
CAAAGGGAAGAAAGA
C CAGTGA
C06 CAGTGA
C06 CAGTGA
C CAGTGA 3 ′ORF1a / 1b и 14048–14061 TFO7 ** UUUUUAUUUUUAU
C C
C C
UUUUUAU419 9042 9 Полужирным шрифтом выделена область связывания.
Несвязанный циркулярный TFO.2.3. Денатурирующий электрофорез в полиакриламидном геле
Денатурирующий электрофорез в полиакриламидном геле мочевины проводили, как описано ранее [19], с модификацией. Вкратце, получали 20% геля денатурированного полиакриламида мочевины и полимеризовали в течение 30 минут. Затем гель предварительно прогоняли при 20-40 В в течение 45 минут. Пять мкл л РНК TFO, смешанных с 5 мкл л загрузочного буфера мочевины, нагревали при 92 ° C в течение 2 минут и сразу же охлаждали на льду.Его прогоняли на геле при 200 В в течение 45 минут. Наконец, гель окрашивали бромидом этидия (Sigma, США) и просматривали с помощью системы Bio-Rad Gel Doc XR (Калифорния, США).
2.4. Анализ сдвига электрофоретической подвижности (EMSA)
Целевые области генома FIPV были синтезированы Dharmacon Research (США) (таблица 1). Каждую РНК TFO смешивали с целевой областью в 1X связывающем буфере, содержащем 25 мМ Трис-HCl, 6 мМ MgCl 2 и 10 мМNaCl в конечном объеме 10 мкл л, а затем инкубировали при 37 ° C в течение 2 часов. .Образец прогоняли на 15% натуральном полиакриламидном геле при 80 В в холодных условиях. Окрашенный гель просматривали с помощью системы Bio-Rad Gel Doc XR.
2,5. Взаимодействие между кольцевыми РНК TFO и целевыми областями
Силу связывания измеряли с использованием наноизотермического калориметра для титрования (ITC) (TA instruments, Newcastle, UK). Смеси образцов РНК, состоящие из кольцевых ТФО (0,0002 мМ), инкубировали с их соответствующими синтетическими целевыми областями (0,015 мМ), используя 1X связывающий буфер в качестве разбавителя.Эксперимент проводили при 37 ° C с 2 мкл л на инъекцию, всего 25 инъекций. Данные собирались каждые 250 секунд и анализировались с помощью программного обеспечения NanoAnalyze v2.3.6, предоставленного производителем.
2.6.
In vitro Противовирусный эффект TFO по отношению к FIPVЭтот эксперимент проводили на клетках CRFK, где 3 × 10 4 клеток / лунку высевали в 96-луночный планшет для достижения 80% конфлюэнтности за 24 часа до трансфекции. Сто нМ РНК TFO отдельно трансфецировали в клетки CRFK с использованием реагента для трансфекции HiPerFect (Qiagen, Германия) в соответствии с протоколом производителя.Планшет инкубировали при 37 ° C с 5% CO 2 в течение 6 часов. Затем культуры инфицировали 100TCID 50 штамма FIPV серотипа II WSU 79–1146 в течение 1 часа при 37 ° C (100 мкл л / лунку). Наконец, вирусный инокулят заменяли свежей поддерживающей средой (MEM, содержащей 1% FBS и 1% pen / strep). Зараженные вирусом и неинфицированные клетки поддерживали в качестве положительного и отрицательного контроля соответственно. Морфологию культур регистрировали через 72 часа после заражения, и в этот момент времени собирали образцы и хранили при -80 ° C перед экстракцией РНК.
2.7. Доза-ответ кольцевой РНК TFO при ингибировании репликации FIPV
Различные концентрации кольцевой РНК TFO1 (25 нМ, 50 нМ, 100 нМ и 500 нМ) трансфицировали в клетки CRFK. Планшет инкубировали в течение 6 часов с последующим заражением вирусом в течение 1 часа при 37 ° C с 5% CO2. Клетки обрабатывали, как описано выше.
2,8.
In vitro Исследование специфичности кольцевых РНК TFO по отношению к вирусу гриппа AКлетка Madin-Darby Canine Kidney (MDCK) (ATCC No.CCL-34) в концентрации 4 × 10 4 клеток / лунку высевали в 96-луночный планшет для достижения 80% конфлюэнтности за 24 часа до трансфекции. Трансфекцию проводили так же, как и раньше. Сто нМ кольцевой РНК TFO трансфицировали в клетки MDCK. После 6 часов инкубации раствор отбрасывали и 100TCID 50 вируса гриппа A подтипа h2N1 New Jersey 8/76 (ATCC VR-897) инокулировали в планшет на 1 час при 37 ° C. Вирусные инокуляты заменяли модифицированной по Дульбекко средой Игла (DMEM) (Mediatech Cellgro Company; Нортбрук, Иллинойс, США), содержащей трипсин- (тозиламид-2-фенилэтилхлорметилкетон) TPCK (Sigma, США).Образцы собирали через 48 часов и хранили при -80 ° C перед экстракцией РНК.
2.9. Количественная ПЦР с обратной транскриптазой в реальном времени
Вирусную РНК экстрагировали из 100 мкл л собранной клеточной культуры с использованием набора для экстракции вирусной РНК QIAamp (Qiagen, Германия) в соответствии с протоколом производителя. Зараженные вирусом и неинфицированные клетки поддерживали в качестве положительного и отрицательного контроля соответственно. Праймеры для амплификации FIPV и h2N1 (таблица 2) были основаны на установленных ранее праймерах, сконструированных ранее [20, 21] соответственно.Количественную ПЦР в реальном времени с обратной транскриптазой (RT-qPCR) проводили с использованием системы реального времени Bio-Rad CFX96 (BioRad, США). Реакцию амплифицировали до конечного объема 25 мкл л с использованием набора SensiMix SYBR No-ROX One-Step Kit (Bioline, UK), который состоял из 12,5 мкл л 2X SensiMix SYBR No-Rox One-Step реакционного буфера. , 10 мкМ М прямых и обратных праймеров, 10 единиц ингибитора РНКазы RiboSafe и 5 мкл L матричной РНК. Для количественной оценки результатов кПЦР использовался подход абсолютной количественной оценки, когда перед количественной оценкой строилась стандартная кривая серийного разведения вируса.Количество вируса в образцах определяли количественно на основе этой стандартной кривой.
Мишень Праймер Последовательность праймера (от 5 ‘до 3’) Местоположение Ссылка Размер ампликона (bp1042 )FIPV-F GGCAACCCGATGTTTAAAACTGG 29082-29105 Herrewegh et al.(1995) [20] 223 FIPV-R CACTAGATCCAGACGTTAGCTC 29305-29283 h2N1 M2-F CAGAC M2-F CAGAC M2-F Mehrbod et al. (2012) [21] 147 M2-R AGC AAC GAG AGG ATC ACT TG 760-779 2 Статистический анализ
Статистический анализ данных был выполнен с использованием SPSS 18.0. Данные были представлены как среднее значение ± стандартная ошибка трех независимых тестов. Односторонний дисперсионный анализ ANOVA, апостериорный критерий Тьюки использовался для анализа значимого уровня данных. считалось значительным.
3. Результаты
3.1. Дизайн кольцевых РНК TFO против FIPV
Циркулярные РНК TFO, нацеленные на геном FIPV, были разработаны в соответствии с методом образования тройной спирали, описанным Vo и его коллегами [22] с модификацией. Три различных участка генома FIPV, которые играют важную роль в репликации вируса, были выбраны в качестве сайтов связывания-мишени для образования триплекса.Целевыми областями были 5 ‘нетранслируемая область (5’ UTR), открытые рамки считывания (ORF) 1a и 1b и 3 ‘нетранслируемая область (3’ UTR) (таблица 1). TFO были созданы дуплексными, поскольку они могут связываться с одноцепочечной целевой областью и преобразовываться в триплекс. Оба конца дуплекса TFO были лигированы линкерной последовательностью или зажимами (C-C) для конструирования кольцевой РНК TFO.
3.2. Определение кольцевой РНК TFO
Денатурирующий анализ PAGE проводили после процесса лигирования для определения образования кольцевого TFO.Как показано на рисунке 1, кольцевые РНК TFO мигрировали быстрее, чем линейные РНК TFO, когда подвергались 20% денатурирующему PAGE.
3.3. Связывающая способность кольцевой РНК TFO по отношению к ее целевой области
Связывающую способность определяли с помощью анализа сдвига электрофоретической подвижности (EMSA) [23]. Появление полосы медленной подвижности указывает на успешную гибридизацию кольцевой РНК TFO с ее областью-мишенью. Связывающую способность различных РНК TFO (TFO1-TFO5) против их целевых областей определяли с помощью EMSA (рис. 2).TFO1, TFO3, TFO4 и TFO5 показали полосу низкой подвижности, тогда как TFO2 показал отсутствие полосы, смещенной вверх. Это указывает на обладание триплексной способностью связывания для всех кольцевых РНК TFO, кроме TFO2.
3.4. Исследование кольцевой РНК TFO с помощью калориметра нано-изотермическим титрованием
Исследование взаимодействия и гибридизации TFO с его целевой областью имеет решающее значение, поскольку чем сильнее связывание, тем более стабильной формируется триплексная структура. Как показано на дополнительном рисунке 1 (в дополнительных материалах, доступных онлайн по адресу http: // dx.doi.org/10.1155/2014/654712), все кольцевые РНК TFO (кроме TFO2) показали высокие уровни константы ассоциации (). Следовательно, все кольцевые РНК TFO (кроме TFO2) регистрировали низкое значение константы диссоциации () в обратной зависимости от этого значения. TFO1 показал наименьшее значение (таблица 3).
Круговая РНК TFO (константа ассоциации) (константа диссоциации) (нМ) 18 2 — — 3 9359929,6 107 4 8446828 находится в обратной зависимости от. 3.5. Противовирусный эффект кольцевых РНК TFO против FIPV
Противовирусный эффект кольцевых РНК TFO исследовали с помощью анализа RT-qPCR через 72 часа после трансфекции.Результаты показали, что число копий генома вирусной РНК составляет 3,65 × 10 9 , 3,22 × 10 14 , 5,04 × 10 9 , 5,01 × 10 9 , 4,41 × 10 9 и 3,96 × 10 14. в клетках, обработанных TFO1, TFO2, TFO3, TFO4, TFO5 и TFO7 соответственно. Данные, проанализированные с помощью однофакторного дисперсионного анализа (ANOVA), апостериорного теста Тьюки, показали значительное высокое число копий вирусного генома РНК 4,03 × 10 14 для клеток, инокулированных вирусом, по сравнению с циклическими обработками TFO1, TFO3, TFO4 и TFO5 ().Копии вирусной РНК кольцевых клеток TFO2, линейных TFO3 и TFO4 и неродственных кольцевых РНК TFO7, трансфицированных клетками, также показали высокие числа копий вирусной РНК, которые не показали значительных отличий от инфицированных клеток () (рис. 3). Морфологические изменения клеток также фиксировались через 72 часа после трансфекции. Клетки, трансфицированные кольцевым TFO1, TFO3, TFO4 и TFO5, оказались в хорошем состоянии после инокуляции вируса, в то время как клетки, трансфицированные кольцевым TFO2 и линейным TFO3 и TFO4, показали видимый цитопатический эффект (CPE), такой же, как и клетки, инокулированные вирусом ( дополнительный рисунок 2).Кроме того, клетки, трансфицированные TFO, остаются только жизнеспособными, что указывает на то, что обработка TFO обычно не токсична для клеток. Следовательно, эти результаты иллюстрируют способность кольцевых РНК TFO (кроме TFO2) ингибировать репликацию FIPV.
3.6. Влияние кольцевой РНК TFO в различных концентрациях на репликацию FIPV
Циркулярный TFO1 был использован для исследования зависимости доза-ответ в качестве представителя других TFO. Условия эксперимента были идентичны условиям предыдущего эксперимента, за исключением концентраций TFO1 25 нМ, 50 нМ, 100 нМ и 500 нМ.Не наблюдалось значительного снижения копий вирусного генома РНК при использовании концентрации 25 нМ TFO1. Другие концентрации вызывали значительное уменьшение количества копий по сравнению с инфицированными вирусом клетками. Однако не было обнаружено значительного различия в количестве копий для всех этих концентраций (рис. 4).
3.7. Противовирусное действие кольцевых РНК TFO на неродственный вирус
Специфичность TFO по отношению к FIPV была протестирована с использованием TFO1 и TFO5, как соответствующих представителей TFO, на вирусе гриппа A h2N1 New Jersey 8/76.Данные, проанализированные с использованием однофакторного дисперсионного анализа, апостериорного теста Тьюки, не показали значительного снижения количества копий вирусной РНК для обоих TFO по сравнению с клетками, инокулированными вирусом гриппа () (дополнительная фигура 3).
4. Обсуждение и заключение
Кошачий инфекционный перитонит — смертельное заболевание среди кошачьих популяции. Современные методы лечения и вакцины неэффективны для борьбы с болезнью. 5 ‘и 3’ UTR вирусной мРНК представляют собой высококонсервативные последовательности и играют важную роль в процессе репликации [24].Между тем, ORF1a / 1b FIPV транслируется в полипротеины, которые расщепляются на неструктурные белки, которые собираются в репликационно-транскрипционные комплексы вместе с другими вирусными белками [24]. Следовательно, разработка молекулярной терапии, нацеленной на эти критические области, может предоставить возможность ингибировать репликацию FIPV.
Разработка противовирусных препаратов против FIPV с использованием миРНК [25] и ингибиторов вирусных протеаз [26] была протестирована в качестве потенциальных новых методов лечения инфекции FIPV.В этом исследовании были разработаны и оценены кольцевые РНК олигонуклеотидов, образующих тройную спираль (TFO), специально нацеленные на короткие области вирусного генома для образования триплекса. TFO1 и TFO2 нацелены на 5′- и 3′-UTR вирусного генома соответственно. TFO3 в TFO5 нацелены на различные области ORF1a / 1b в геноме FIPV. Перед антивирусным исследованием in vitro лигированные кольцевые TFO оценивали с помощью анализа PAGE. Все циркулярные TFO показали более быструю картину миграции по сравнению с линейными TFO; тем не менее, для некоторых TFO было обнаружено лишь небольшое изменение (рис. 1).Причина этого не ясна, но, вероятно, из-за различий в длине и третичной структуре TFOs, что приводит к различиям в скорости миграции. EMSA использовали для демонстрации способности каждого кольцевого TFO связываться с целевой областью в геноме FIPV, за исключением TFO2, который показал отсутствие образования сложной структуры при гибридизации (рис. 2). Результат EMSA также совпал с антивирусным исследованием, в котором все кольцевые TFO (кроме TFO2) смогли продемонстрировать значительное снижение числа копий вирусного РНК генома на 5-кратный логарифм 10 с 10 14 в зараженных вирусом клетках до 10 9 в клетках, трансфицированных ТФО (рис. 3).Однако не было обнаружено противовирусных свойств линейных TFO и неродственных кольцевых РНК TFO7, что подтверждает, что противовирусная активность связана со специфическим связыванием кольцевых TFO с целевыми областями.
Кроме того, связывание кольцевого TFO с целевой областью было подтверждено анализом nanoITC; где низкое значение и высокая стабильность позволяют TFO эффективно конкурировать с целевыми областями для ингибирования транскрипции в бесклеточных системах. Поскольку TFO1 показывает самое низкое значение (таблица 3), противовирусные свойства этого TFO были оценены в исследовании доза-эффект.Как показано на фиг. 4, 50 и 100 нМ TFO1 показали аналогичные противовирусные эффекты, что указывает на потенциальное терапевтическое применение TFO1 в отношении репликации FIPV. Однако увеличение концентрации TFO1 до 500 нМ не привело к дальнейшему снижению вирусной нагрузки, вероятно, из-за неэффективности реагента для трансфекции трансфекции TFO в клетки. Кроме того, вирус имеет высокую скорость репликации при инфицировании in vitro , где предыдущее исследование роста FIPV в клетках CRFK показало, что через 2 часа примерно 67% FIPV 79-1146 интернализовалось клетками CRFK за счет эндоцитоза, увеличиваясь до более более 70% через 3 часа [27, 28].Вышеуказанное открытие, вероятно, также объясняет причину, по которой не было обнаружено противовирусного эффекта, когда трансфекция TFO выполнялась на инфицированных вирусом клетках (данные не показаны).
Противовирусные свойства, как продемонстрировали кольцевые TFO, вероятно, были связаны со связыванием TFO с целевой областью на основе водородных связей Уотсона-Крика и Хугстина, которые повышают стабильность с точки зрения энтальпии, т.е. вызвано соединением вместе двух из трех нитей тройной спирали в правильной ориентации [29].Следовательно, образование триплекса прочно связано и его нелегко отсоединить. Кроме того, кольцевые TFO были сконструированы таким образом, что присутствие доноров и акцепторов водородных связей в пуринах способно образовывать две водородные связи, в то время как пиримидиновые основания могут образовывать только одну дополнительную водородную связь с поступающими третьими основаниями [30]. Однако существуют различные факторы, которые могут ограничивать активность TFO в клетках, такие как внутриклеточная деградация TFO и ограниченная доступность TFO к сайтам-мишеням, что может предотвратить образование триплекса [31].Эти результаты могут также объяснить неспособность сконструированного TFO1 ингибировать дальнейшую репликацию вируса в исследовании зависимости от дозы (рис. 4).
Были разработаны и испытаны различные молекулярные методы лечения инфекционных заболеваний и рака. Однако только терапия на основе миРНК широко изучалась как новая противовирусная и противораковая терапия [32, 33]. Недавно McDonagh et al. [25] разработали миРНК с противовирусной активностью против FIPV 79-1146, при этом созданная миРНК была способна уменьшить количество копий вирусного генома по сравнению с инфицированными вирусом клетками.Потенциальное терапевтическое применение TFO, таких как линейный TFO, конъюгированный с псораленом, для ингибирования транскрипции провируса иммунодефицита человека [13] и TFO, чтобы ингибировать транскрипцию коллагена α 1 (I) в фибробластах крыс [14], также было изучено. сообщил. Кроме того, короткий TFO, конъюгированный с дауномицином, нацеленный на промоторную область онкогена, был разработан и испытан на раковых клетках человека [31]. Эти исследования показали гибкость использования олигонуклеотидов на основе ТФО в качестве потенциальной молекулярной терапии.В этом исследовании мы продемонстрировали короткие кольцевые РНК TFO размером от 28 до 34 меров (таблица 1), которые способны ингибировать репликацию FIPV путем связывания со специфическими областями-мишенями генома FIPV.
Все разработанные кольцевые TFO (кроме TFO2) показали значительные ингибирующие эффекты против репликации FIPV. TFO, которые образуют триплексные структуры, проявляют противовирусное действие в отношении репликации FIPV. Причина, по которой TFO2 не продемонстрировал какого-либо взаимодействия с целевой областью или противовирусной активности, вероятно, связана с длиной TFO2 (т.е.е., 24 мера), которого может быть недостаточно для образования триплекса при гибридизации (рис. 2), быть достаточно эффективным, чтобы подавить транскрипцию вирусной РНК и, в конечном итоге, подавить репликацию вируса. Тем не менее нельзя исключать неспособность TFO2 проявлять противовирусный эффект из-за нарушения формирования функциональной третичной структуры образования триплекса. In vitro противовирусное исследование , которое не показало антивирусных свойств для неродственного TFO (TFO7), а также неспособность кольцевых TFO1 и TFO5 ингибировать клетки, инфицированные вирусом гриппа A h2N1, подтверждает специфичность активности TFO.
В заключение, кольцевая РНК TFO может быть разработана в качестве терапии против FIPV у кошек. Тем не менее, дальнейшие исследования специфичности TFO, фактического механизма циркулярной РНК TFO в результате изменения транскрипции в результате ингибирования процесса вирусной транскрипции и in vivo исследований на животных важны для того, чтобы этот подход работал в качестве терапии в будущем.
Конфликт интересов
Авторы заявили, что конфликта интересов не существует.
Вклад авторов
Ои Куан Чунг, Абдул Рахман Омар и Бимо Арио Теджо определили тему исследования. Ои Куан Чунг разработал и провел лабораторные эксперименты, проанализировал и интерпретировал данные и подготовил документ. Ои Куан Чунг, Абдул Рахман Омар и Парване Мехрбод тщательно отредактировали документ. Все авторы прочитали и одобрили итоговую статью.
Благодарности
Работа поддержана грантом № ERGS / 1-2012 / 5527123 от Министерства высшего образования правительства Малайзии.Финансирующая организация не принимала участия в разработке исследования, сборе и анализе данных или подготовке статьи.
Дополнительные материалы
Дополнительный рисунок 1. Анализ NanoITC. Анализ NanoITC измеряет аффинность связывания кольцевого TFO с его целевой областью. Константа диссоциации (Kd) равна 1 / константа ассоциации (Ka). Дополнительная фигура 2. Морфологические изменения клеток CRFK после обработки РНК TFO. Клетки, инфицированные FIPV, подвергнутые воздействию TFO, которые не проявляют цитопатического эффекта (CPE), указывают на ингибирующие эффекты кольцевого TFO против репликации FIPV.Стрелки показывают CPE. 10-кратное увеличение. Дополнительная фигура 3. Противовирусная активность циркулярного TFO in vitro. Противовирусная активность TFO1 (A) и TFO5 (B) in vitro в отношении репликации h2N1 вируса гриппа A не показала значительного снижения числа копий вирусного РНК генома между клетками, трансфицированными РНК TFO, и нетрансфицированными клетками ( p ≥ 0,05). Данные представляют собой средние значения 3 независимых тестов (среднее ± стандартная ошибка). NS: не имеет значения.
- Дополнительные рисунки
(PDF) Антипролиферативный эффект гемоцианина Helix aspersa на множественные злокачественные клеточные линии in vitro
1 1
2 2
3 3
4 4
0002 5 5 60003 7 78 8
9 9
10 10
11 11
12 12
13 13
14 14
15 15
16 16
17 17
18 18 1
20 20
21 21
22 22
23 23
24 24
25 25
26 26
27 27
28 28
29 29
30 30
312 312 32 32
33 33
34 34
35 35
36 36
37 37
38 38
39 39
40 40
41 41
42 42
43 43
45 45
46 46
47 47
48 48
49 49
50 50
51 51
52 52
53 53
54 54
О.Антонова и др. · Влияние гемоцианинов на рак мочевого пузыря 9
Botteman MF, Pashos CL, Redaelli A., Laskin B. и
Hauser R. (2003), Экономика здоровья при раке мочевого пузыря —
cer: всесторонний обзор опубликованная литература.
Pharmacoeconomics 21, 1315 — 1330.
Боянова О., Долашка П., Тончева Д., Раммензее Х.-Г.,
и Стеванович С. (2013), Эффект моллюскана
гемоцианинов на CAL -29 и Т-24
линий рака мочевого пузыря.Биомед. Rep. 1, 235 — 238.
Берк Г. П., Смит К. А., Стокинг Р., Ферм М. и Макин-
шина О. Р. (1977), Тело гемоцианина блюдечка против замочной скважины и антитела к
у нормальных нечувствительных людей. J. Allergy Clin.
Immunol. 59, 309 — 313.
Институт исследования рака — Нью-Йорк (2013), Сравнение
дендритных клеток и монтанида в качестве адъювантов в вакцине от мела-
ном. http://www.clinicaltrials.gov/ct2/show/
NCT00124124? term = KLH ++ меланома & rank = 2.Acces-
sed 06.02.2013.
Кэмерон Р. А. и Картер М. А. (1979) Внутри- и меж-
специфические эффекты плотности популяции на рост и активность
у некоторых наземных спиралевидных улиток (Gastropoda: Pulmonata).
J. Anim. Ecol. 48, 237 — 246. «В тексте не цитируется»
Cameron,, and (1978),.
Del Campo M., Arancibia S., Nova E., Salazar F.,
González A., Moltedo B., De Ioannes P., Ferreira J.,
Manubens A., и Беккер М. (2011), Hemocyanins as
immunostim. Rev. Med. Chil. 139, 236–246.
Ферли Дж., Шин Х.Р., Брей Ф., Форман Д., Мазерс К. и
Паркин Д.М. (2010), Оценки мирового бремени рака
в 2008 г .: GLOBOCAN 2008. Int. J. Cancer 127,
2893 — 2917.
Джусти Ф., Манганелли Г. и Шембри П. Дж. (1995), Неморские моллюски
Мальтийских островов, моно-
график XV. Museo Regionale di Scienze Naturali, Турин,
Италия.
Хортобаджи Г. Н., Смит Т. Л., Свенертон К. Д., Легха С. С.,
Буздар А. У., Блуменшейн Г. Р., Гуттерман Дж. У. и
Херш Э. М. (1981), Прогностическое значение прехимиотерапии
кожных пробы груди у пациентов с карцином рака груди.
Cancer 47, 1369 — 1376.
Lamm D. L. (2003), Лабораторный и клинический опыт с
гемоцианином моллюска улитки (Immucothel®) при супер-
раке мочевого пузыря. J. Urol. Urogynäkol.(Österreich) 10,
18–21.
Ламм Д. Л., Де Хейвен Дж. И. и Риггс Д. Р. (2000),
Иммунотерапия гемоцианином моллюска у замочной скважины при раке мочевого пузыря
: лабораторные и клинические исследования. Евро. Урол. 37,
41-44.
Линдси Г., Рослански П. и Новицкий Т. (1989), Single-
step, хромогенный анализ лизата амебоцитов Limulus на эн-
дотоксин. J. Clin. Microbiol. 27, 947 — 951.
Мак Фадден Д. У., Риггс Д. Р., Джексон Б.J. и Vona-
Davis L. (2003), Гемоцианин лимфы улитки, новый иммуностимулятор
с многообещающей противораковой активностью при аденокарциноме пищевода
Барретта. Являюсь. J. Surg. 186,
552 — 555.
Мольтедо Б., Фаунес Ф., Османн Д., Де Иоаннес П., Де
Иоаннес А.Е., Пуэнте Дж. И Беккер М.И. (2006), Им-
, муотерапевтический эффект гемоцианина Concholepas в модели
рака мочевого пузыря у мышей: данные о сохранении
противоопухолевых свойств гемоцианинов.J. Urol. 176,
2690 — 2695.
Обаяси Т., Тамура Х., Танака С., Оки М., Такахаши С.,
Араи М., Масуда М. и Каваи Т. (1985), Новый
хромогенный эндотоксин-специфический анализ с использованием рекомбинированных ферментов коагуляции
limulus и его клиническое применение.
Clin. Чим. Acta 149, 55–65.
Olsson C., Chute R., and Rao C. (1974), Immunologic re-
duction для частоты рецидивов рака мочевого пузыря. J. Urol. 111,
173 — 176.
Presicce P., Taddeo A., Conti A., Villa ML, and Della
Bella S. (2008), Гемоцианин лимфы улитки
индуцирует активацию и созревание дендритных клеток человека
посредством участия рецептора маннозы . Мол. Im-
мунол. 45, 1136 — 1145.
Риггс Д. Р., Джексон Б., Вона-Дэвис Л. и Мак Фадден Д.
(2002), Противораковые эффекты in vitro нового иммуно-
стимулятора: гемоцианин лимфы улитки. J. Surg.Res. 108,
279 — 284.
Риггс Д.Р., Джексон Б.Дж., Вона-Дэвис Л., Нигам А. и Мак.
Фадден Д.В. (2005), Эффекты гемоцианина
при раке груди и поджелудочной железы in vitro в отношении роста клеток
, продукции цитокинов и апоптоза. Являюсь. J.
Surg. 189, 680 — 684.
Sarker MR and Zhong M. (2014), Keyhole limpet hemo-
цианин увеличивал убивающую активность, продукцию цитокинов
,и пролиферацию NK-клеток, а также подавлял пролиферацию Meth. Клетки саркомы in vitro.Indian J. Pharmacol.
46, 40 — 45.
Стайков А. и Лазариду-Димитриаду М. (1989), Влияние скопления
на рост и смертность съедобной улитки Helix
lucorum Linnaeus (Gastropoda Pulmonata) в Греции. Является.
J.

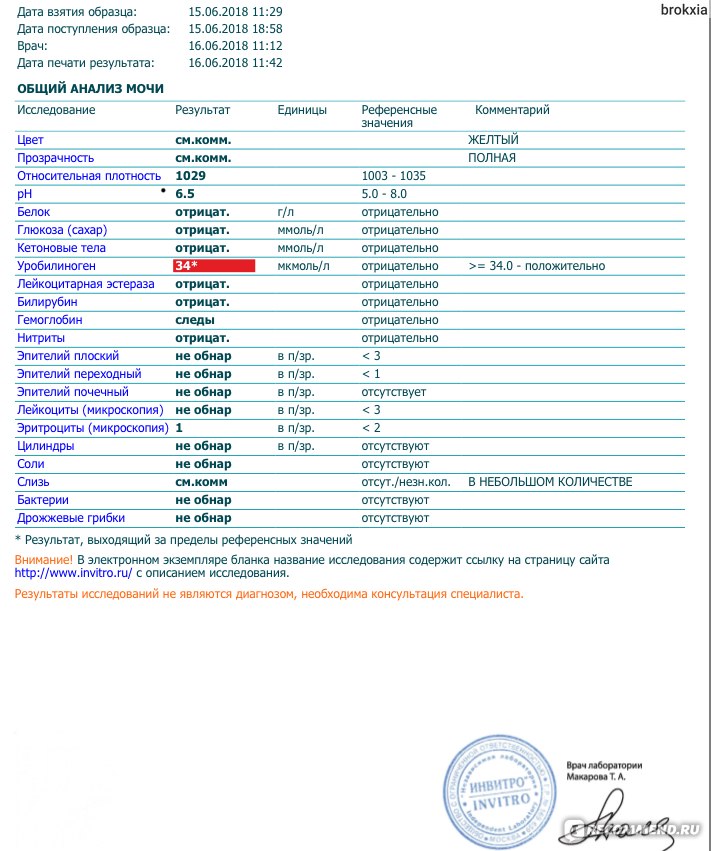 4 МЕ/мл. Она этот анализ сдавала как в Хеликсе, так и во многих других клиниках уже многие и многие годы.
4 МЕ/мл. Она этот анализ сдавала как в Хеликсе, так и во многих других клиниках уже многие и многие годы.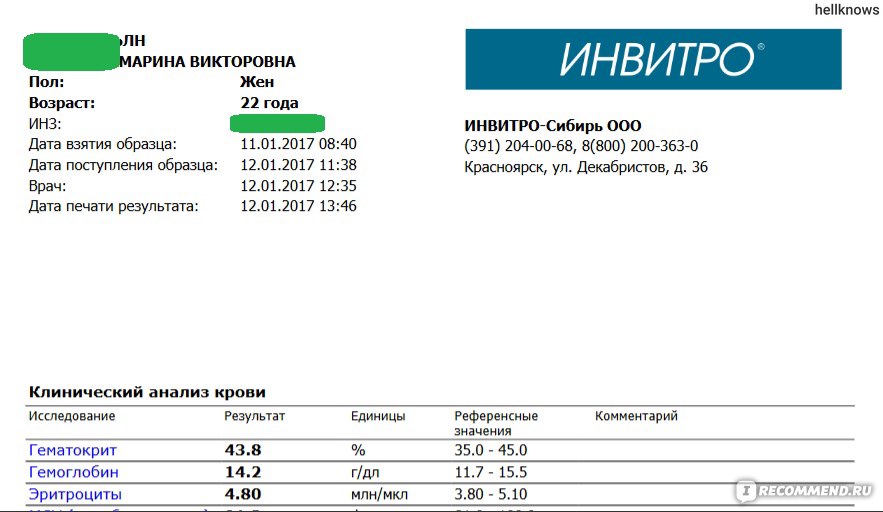 к. в Хеликсе — совершенно случайные числа никак не связанные с реальностью. Сдал анализ, вроде все в норме, а на самом деле, далеко не в норме.
к. в Хеликсе — совершенно случайные числа никак не связанные с реальностью. Сдал анализ, вроде все в норме, а на самом деле, далеко не в норме. Как это сочетается с заявлениями мэра Собянина о том, что антитела свидетельствуют об иммунитете — непонятно.
Как это сочетается с заявлениями мэра Собянина о том, что антитела свидетельствуют об иммунитете — непонятно.
 Если у вас только IgG, то Вы уже реконвалесцент (выздоровевший — ред.) и могли встретиться с вирусом какое-то время назад», — пишет Фаворов.
Если у вас только IgG, то Вы уже реконвалесцент (выздоровевший — ред.) и могли встретиться с вирусом какое-то время назад», — пишет Фаворов. И могут повлечь за собой самоизоляцию на две недели, а «с учетом особенностей клинического процесса до 3 недель». Показатели IgM меньше 1,0 и IgG равных или больше 10,0 означают «наличие иммунологической памяти на контакт с вирусом SARS-CoV-2» и, если нет информации о ранее перенесенной новой коронавирусной инфекции, тоже могут означать самоизоляцию на 2 недели.
И могут повлечь за собой самоизоляцию на две недели, а «с учетом особенностей клинического процесса до 3 недель». Показатели IgM меньше 1,0 и IgG равных или больше 10,0 означают «наличие иммунологической памяти на контакт с вирусом SARS-CoV-2» и, если нет информации о ранее перенесенной новой коронавирусной инфекции, тоже могут означать самоизоляцию на 2 недели. «Информация не соответствует действительности. Якобы утвержденных алгоритмов, о которых говорится в материалах, не существует. Пациентам, у которых выявлены иммуноглобулины G, говорящие об иммунитете к вирусу, никакие постановления или предписания о самоизоляции не выдаются», — утверждает департамент.
«Информация не соответствует действительности. Якобы утвержденных алгоритмов, о которых говорится в материалах, не существует. Пациентам, у которых выявлены иммуноглобулины G, говорящие об иммунитете к вирусу, никакие постановления или предписания о самоизоляции не выдаются», — утверждает департамент.


 ) с использованием оборудования Mindray».
) с использованием оборудования Mindray».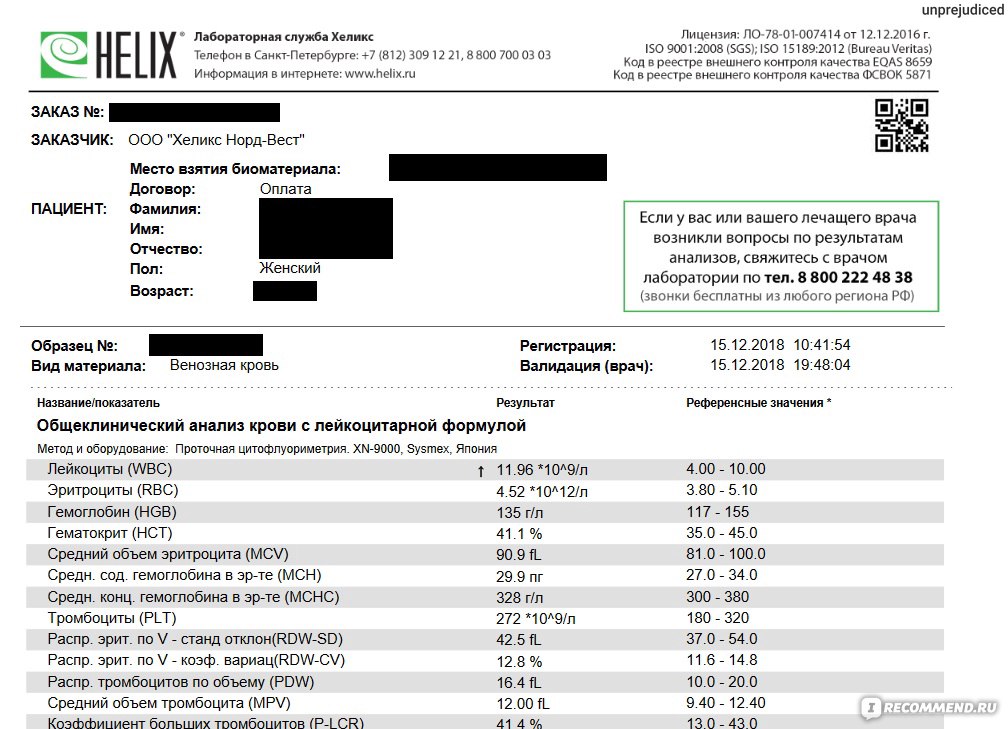 На момент публикации ни оперштаб, ни «Миндрей медикал рус» не ответили на вопрос о том, действительно ли эти тесты обеспечивают массовую проверку москвичей. В системе госзакупок не удалось обнаружить никаких контрактов, связанных с этим.
На момент публикации ни оперштаб, ни «Миндрей медикал рус» не ответили на вопрос о том, действительно ли эти тесты обеспечивают массовую проверку москвичей. В системе госзакупок не удалось обнаружить никаких контрактов, связанных с этим.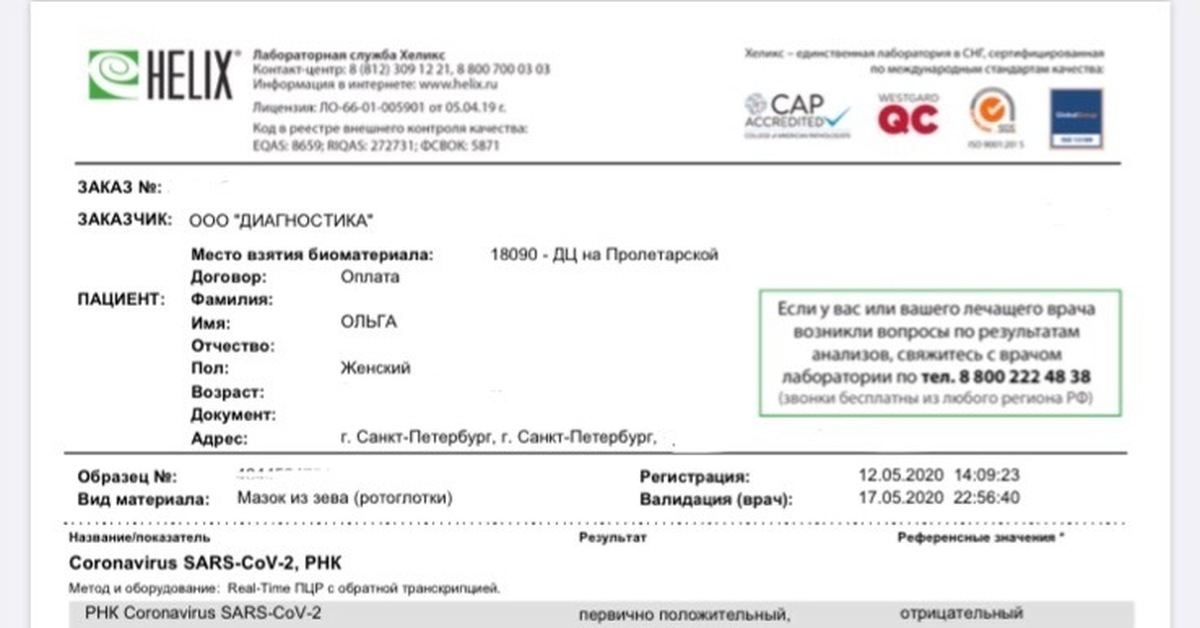 ), а потом просто вычесть эти четыре процента из полученного результата. Для этого важна твоя точность представлений об этом тесте. Поэтому очень большой вопрос, насколько точно мы знаем аналитические характеристики этого теста», — говорит она.
), а потом просто вычесть эти четыре процента из полученного результата. Для этого важна твоя точность представлений об этом тесте. Поэтому очень большой вопрос, насколько точно мы знаем аналитические характеристики этого теста», — говорит она.

 Пока что в его базе данных из 74 экспериментов с тестированием упоминаний о московском нет, а самой массовой следует считать программу тестирования в Испании с упоминанием о 60 тысячах участников. Если Москва обеспечит хотя бы половину из заявленных 70 тысяч в неделю до конца мая, это исследование будет самым значительным по масштабу среди других.
Пока что в его базе данных из 74 экспериментов с тестированием упоминаний о московском нет, а самой массовой следует считать программу тестирования в Испании с упоминанием о 60 тысячах участников. Если Москва обеспечит хотя бы половину из заявленных 70 тысяч в неделю до конца мая, это исследование будет самым значительным по масштабу среди других.
 Для того, чтобы получать настоящую статистику, надо действительно брать случайных людей», — считает он. Ефимов не видит вреда в том, что, пусть и с какой-то вероятностью статистических ошибок, такое массовое тестирование состоится.
Для того, чтобы получать настоящую статистику, надо действительно брать случайных людей», — считает он. Ефимов не видит вреда в том, что, пусть и с какой-то вероятностью статистических ошибок, такое массовое тестирование состоится.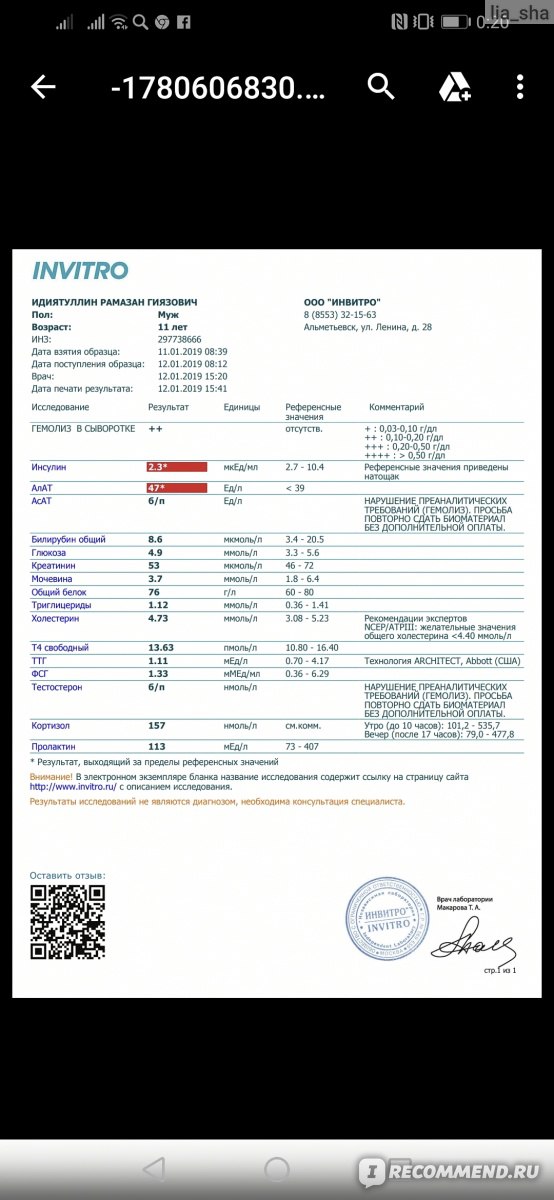 «Это большие числа. Это все же дает картину того, сколько человек переболели в популяции. И другого способа получить ее не существует. Пускай даже и будет ошибка в три-четыре процента, я не считаю ее фатальной. Массовый скрининг даст возможность, принимая во внимание большую надежность иммунологического теста в сравнении с ПЦР (тот самый мазок у больных в активной фазе — ред.), установить реальный процент переболевших, эффективность принятых мер. Что нам ждать, насколько высока прослойка иммунной защиты в популяции. Эти данные можно получить только «в поле», их нельзя вычислить».
«Это большие числа. Это все же дает картину того, сколько человек переболели в популяции. И другого способа получить ее не существует. Пускай даже и будет ошибка в три-четыре процента, я не считаю ее фатальной. Массовый скрининг даст возможность, принимая во внимание большую надежность иммунологического теста в сравнении с ПЦР (тот самый мазок у больных в активной фазе — ред.), установить реальный процент переболевших, эффективность принятых мер. Что нам ждать, насколько высока прослойка иммунной защиты в популяции. Эти данные можно получить только «в поле», их нельзя вычислить». Энгельгардта академик Макаров заявил, что в глобальном исследовании тест-систем на антитела к коронавирусу «была и наша система. Хочу отметить, что она заняла хорошее место, первое-второе поделила».
Энгельгардта академик Макаров заявил, что в глобальном исследовании тест-систем на антитела к коронавирусу «была и наша система. Хочу отметить, что она заняла хорошее место, первое-второе поделила». постановления Главного государственного санитарного врача по ЯНАО от 13.05.2020 N 14)
постановления Главного государственного санитарного врача по ЯНАО от 13.05.2020 N 14) Новый Уренгой. Ежедневно в округе осуществляется тестирование в объеме от 1700 до 2100 исследований, отмечается высокий уровень верификации положительных (сомнительных) проб, 85% и более в течение 10 дней.
Новый Уренгой. Ежедневно в округе осуществляется тестирование в объеме от 1700 до 2100 исследований, отмечается высокий уровень верификации положительных (сомнительных) проб, 85% и более в течение 10 дней. 6070; 2008, N 29 (ч. 1), ст. 3418; 30 (ч. П), ст. 3616; 2009, 1, ст. 17; 2010, N 40, ст. 4969; 2011, N 1, ст. 6, 30 (ч. 1), ст. 4563, ст. 4590, ст. 4591, ст. 4596; 24, ст. 3069; 26, ст. 3446; 2013, N 27, ст. 3477; 30 (ч. I), ст. 4079), санитарно-эпидемиологическими правилами СП 3.1./3.2. 3146-13 «Общие требования по профилактике инфекционных и паразитарных болезней», методическими рекомендациями МР3.1.0169-20 «Лабораторная диагностика COVID-19», изменения N 1 в МР3.1.0169-20 «Лабораторная диагностика COVID-19» MP 3.1.074-20, MP 3.1.0175-20 постановляю:
6070; 2008, N 29 (ч. 1), ст. 3418; 30 (ч. П), ст. 3616; 2009, 1, ст. 17; 2010, N 40, ст. 4969; 2011, N 1, ст. 6, 30 (ч. 1), ст. 4563, ст. 4590, ст. 4591, ст. 4596; 24, ст. 3069; 26, ст. 3446; 2013, N 27, ст. 3477; 30 (ч. I), ст. 4079), санитарно-эпидемиологическими правилами СП 3.1./3.2. 3146-13 «Общие требования по профилактике инфекционных и паразитарных болезней», методическими рекомендациями МР3.1.0169-20 «Лабораторная диагностика COVID-19», изменения N 1 в МР3.1.0169-20 «Лабораторная диагностика COVID-19» MP 3.1.074-20, MP 3.1.0175-20 постановляю:
 3. При выписке больных с COVID-19 учитывать получение только 2-х отрицательных результатов лабораторных исследований с промежутком не менее одних суток.
3. При выписке больных с COVID-19 учитывать получение только 2-х отрицательных результатов лабораторных исследований с промежутком не менее одних суток.
 А.НЕЧЕПУРЕНКО
А.НЕЧЕПУРЕНКО Салехард, улица Мира, дом 39, место осуществления деятельности г. Салехард, улица Мира, дом 39, литер А, А1
Салехард, улица Мира, дом 39, место осуществления деятельности г. Салехард, улица Мира, дом 39, литер А, А1 Ноябрьск, улица Муравленко, дом 42б
Ноябрьск, улица Муравленко, дом 42б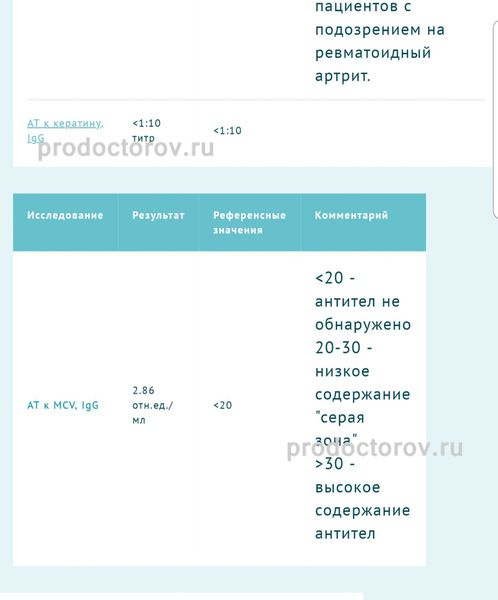 Новый Уренгой, Тазовском районе»
Новый Уренгой, Тазовском районе» 06.2018
06.2018
 05.2020 N 13
05.2020 N 13 Новая Басманная, 10, стр. 1, эт. 5, пом. III, ком. 1
Новая Басманная, 10, стр. 1, эт. 5, пом. III, ком. 1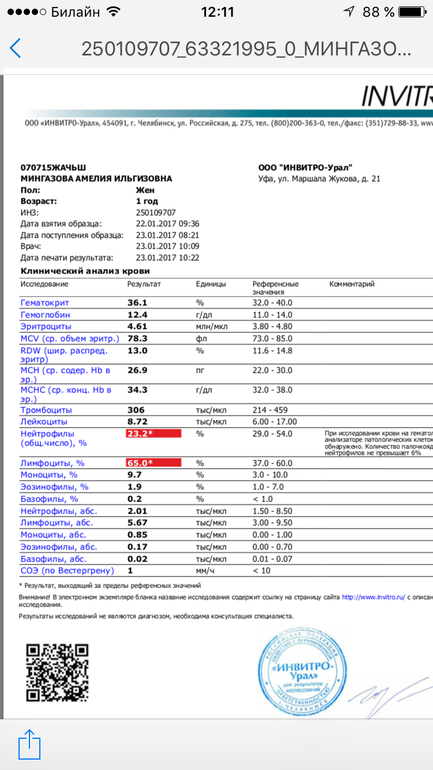 1, ком. 1
1, ком. 1 Высокая, 19, корп. 2
Высокая, 19, корп. 2 ,
, Санкт-Петербург, ул. Жукова, 18Д
Санкт-Петербург, ул. Жукова, 18Д А, пом. 3 Н каб. 3
А, пом. 3 Н каб. 3 Великий Новгород, ул. Большая Санкт-Петербургская, 46а
Великий Новгород, ул. Большая Санкт-Петербургская, 46а Краснодар, ул. Им. Калинина, 201
Краснодар, ул. Им. Калинина, 201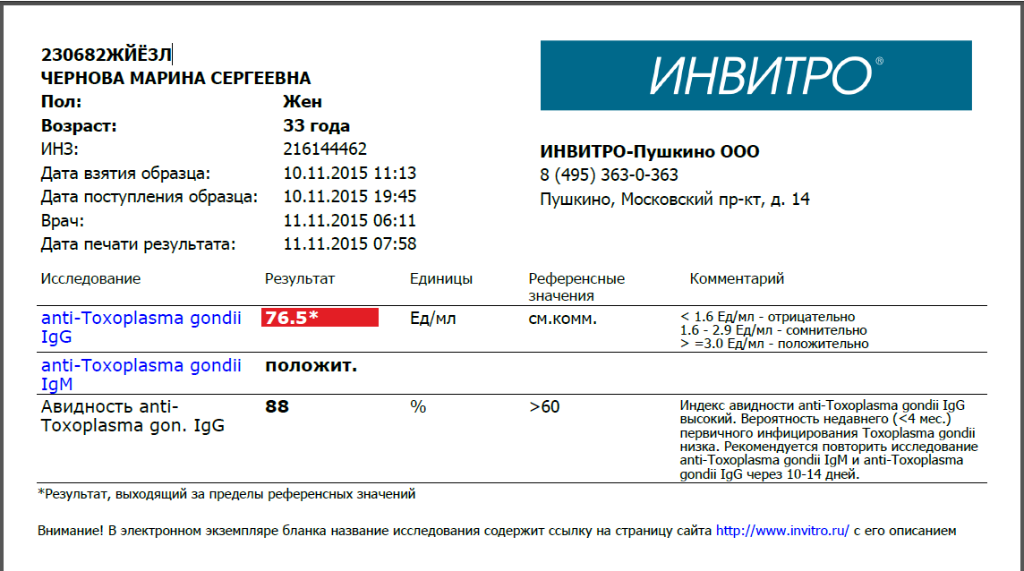 Ленина, 304
Ленина, 304 Уфа, ул. Кирова, 44
Уфа, ул. Кирова, 44 Ижевск,
Ижевск, Самара, Волжское ш., 70
Самара, Волжское ш., 70 Н. Ульянова»
Н. Ульянова»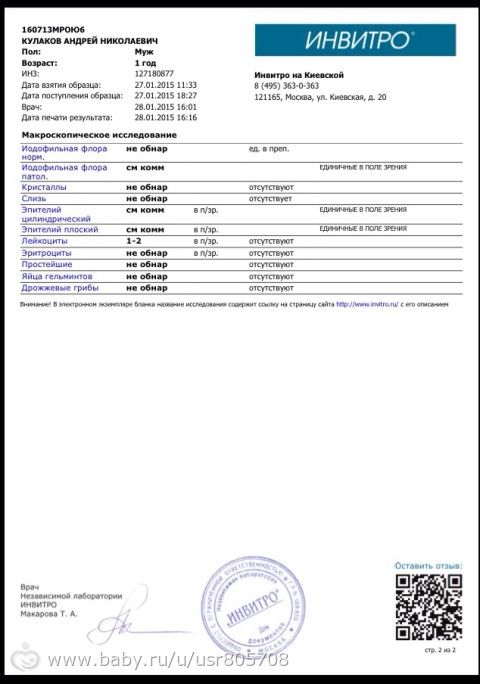 11-й, 26, офис 3
11-й, 26, офис 3 Труда, 187 Б
Труда, 187 Б Барнаул,
Барнаул, 20
20 Новосибирск, ул. Пирогова, 25/4
Новосибирск, ул. Пирогова, 25/4 Томск, Московский тракт, 2
Томск, Московский тракт, 2 В качестве участка для распознавания они используют ген N, ген E и другие фрагменты вирусного генома (обычно это несколько участков, чтобы снизить вероятность ошибок).
В качестве участка для распознавания они используют ген N, ген E и другие фрагменты вирусного генома (обычно это несколько участков, чтобы снизить вероятность ошибок). Более того, и при бессимптомном течении болезни вирусных частиц будет достаточно много для обнаружения. Но уже к десятому дню точность резко падает: вероятность ложноотрицательного диагноза достигает 33%! Неудивительно, что перед выпуском из карантина больных проверяют три-четыре раза.
Более того, и при бессимптомном течении болезни вирусных частиц будет достаточно много для обнаружения. Но уже к десятому дню точность резко падает: вероятность ложноотрицательного диагноза достигает 33%! Неудивительно, что перед выпуском из карантина больных проверяют три-четыре раза. Специфичность же подразумевает, что тест избирателен и не спутает искомый фрагмент вируса ни с чем другим. Эти случаи станут ложноположительными результатами. Низкоспецифичные тесты будут иметь низкую положительно прогностическую значимость, особенно если в популяции мало больных. Так, если заболевших будет всего 5%, то протестировав 100 человек с ошибкой в 5%, мы получим 5 действительно больных и 5 ложноположительных результатов и среди наших 10 диагнозов лишь половина будет верна.
Специфичность же подразумевает, что тест избирателен и не спутает искомый фрагмент вируса ни с чем другим. Эти случаи станут ложноположительными результатами. Низкоспецифичные тесты будут иметь низкую положительно прогностическую значимость, особенно если в популяции мало больных. Так, если заболевших будет всего 5%, то протестировав 100 человек с ошибкой в 5%, мы получим 5 действительно больных и 5 ложноположительных результатов и среди наших 10 диагнозов лишь половина будет верна. Это изменило ситуацию с монополией ГНЦ «Вектор», поначалу поставлявшего наборы с невысокой чувствительностью (105 молекул на миллилитр), требующие для обратной транскрипции дополнительных реагентов. Новые наборы стали более чувствительными (от 500 до 10 000 молекул на миллилитр в образце), в них есть внутренний контрольный образец (молекула, которая помогает обнаружить, что реакция прошла не так при ошибке лаборанта). Лидерами рынка с самым масштабным производством (кроме ГНЦ «Вектор») стали ЦНИИ эпидемиологии Роспотребнадзора, «Вектор-Бест» (не путать с ГНЦ «Вектор) и «ДНК-Технологии». Очень высокая заявленная точность также и у теста от Центра стратегического планирования Минздрава.
Это изменило ситуацию с монополией ГНЦ «Вектор», поначалу поставлявшего наборы с невысокой чувствительностью (105 молекул на миллилитр), требующие для обратной транскрипции дополнительных реагентов. Новые наборы стали более чувствительными (от 500 до 10 000 молекул на миллилитр в образце), в них есть внутренний контрольный образец (молекула, которая помогает обнаружить, что реакция прошла не так при ошибке лаборанта). Лидерами рынка с самым масштабным производством (кроме ГНЦ «Вектор») стали ЦНИИ эпидемиологии Роспотребнадзора, «Вектор-Бест» (не путать с ГНЦ «Вектор) и «ДНК-Технологии». Очень высокая заявленная точность также и у теста от Центра стратегического планирования Минздрава. Лаборатории, одобренные Роспотребнадзором, можно найти здесь.
Лаборатории, одобренные Роспотребнадзором, можно найти здесь.

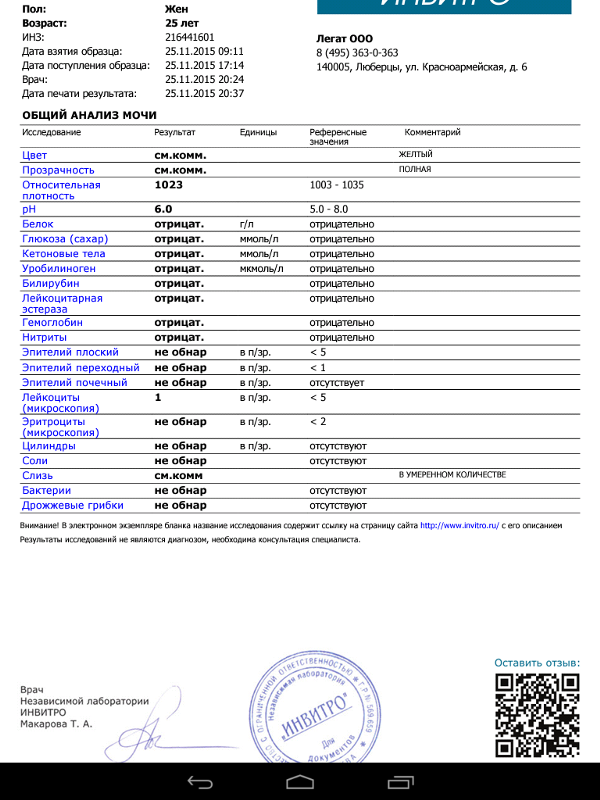
 Ниже приведены наиболее частые причины:
Ниже приведены наиболее частые причины:

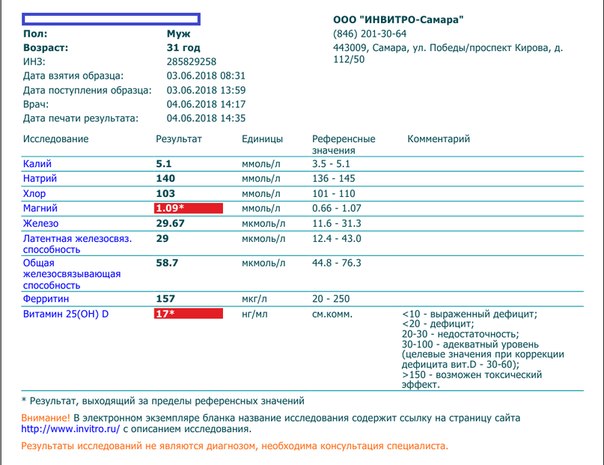 Это также помогает снизить затраты на сбор и решить проблему нехватки клинического персонала по всей стране, чтобы эти ресурсы были направлены туда, где они больше всего нужны.
Это также помогает снизить затраты на сбор и решить проблему нехватки клинического персонала по всей стране, чтобы эти ресурсы были направлены туда, где они больше всего нужны.

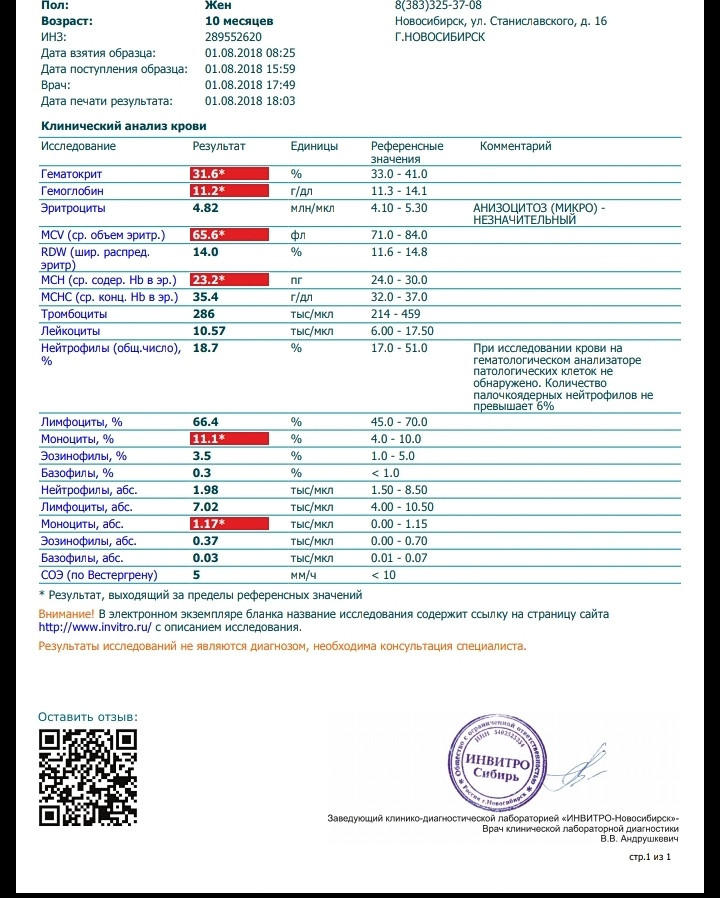
 Узнайте больше на www.helix.com.
Узнайте больше на www.helix.com. В каждый момент времени мы регистрировали 30 минут спонтанной активности: в 3 нестимулированных культурах не наблюдалось никакой всплесковой активности. Чтобы проверить работоспособность сетей и эффективное присутствие синаптических связей, мы провели электрическую стимуляцию в час 72, и . Выбранные клетки были индивидуально пронзены и стимулированы импульсом тока, амплитуда которого была достаточной для преодоления порога возбудимости. В этих условиях мы могли наблюдать сетевую активность, в которой участвовали все нейроны сети (данные не показаны).
В каждый момент времени мы регистрировали 30 минут спонтанной активности: в 3 нестимулированных культурах не наблюдалось никакой всплесковой активности. Чтобы проверить работоспособность сетей и эффективное присутствие синаптических связей, мы провели электрическую стимуляцию в час 72, и . Выбранные клетки были индивидуально пронзены и стимулированы импульсом тока, амплитуда которого была достаточной для преодоления порога возбудимости. В этих условиях мы могли наблюдать сетевую активность, в которой участвовали все нейроны сети (данные не показаны).
 В результате устойчивой деполяризации мембраны сети переходили в состояние покоя перед вымыванием, возможно, из-за инактивации потенциалзависимых натриевых каналов. Фазы до и после стимуляции KCl в основном характеризовались отсутствием активности: до стимуляции сети Helix всегда были полностью молчаливыми (см. Также график IFR, представленный на рисунке 3A). После промывки сеть перешла в состояние покоя, в котором не было зарегистрировано никакой активности: время от времени обнаруживались лишь небольшие колебания в нейронах B2, как показано на рисунке 3A.Основное наблюдение на этих растровых графиках и на кривых IFR за 24–72 часа разработки заключается в том, что KCl не вызывает постоянной активности в сети. Это переходное поведение было постоянным для всех периодов записи во время разработки.
В результате устойчивой деполяризации мембраны сети переходили в состояние покоя перед вымыванием, возможно, из-за инактивации потенциалзависимых натриевых каналов. Фазы до и после стимуляции KCl в основном характеризовались отсутствием активности: до стимуляции сети Helix всегда были полностью молчаливыми (см. Также график IFR, представленный на рисунке 3A). После промывки сеть перешла в состояние покоя, в котором не было зарегистрировано никакой активности: время от времени обнаруживались лишь небольшие колебания в нейронах B2, как показано на рисунке 3A.Основное наблюдение на этих растровых графиках и на кривых IFR за 24–72 часа разработки заключается в том, что KCl не вызывает постоянной активности в сети. Это переходное поведение было постоянным для всех периодов записи во время разработки. е. 6, 24, 36, 48, 54, 72 часа после нанесения покрытия).В первом столбце показано развитие ветвлений нейритов (масштабная полоса 200 мкм). Три столбца растровых графиков показывают одну минуту электрофизиологической активности непосредственно до, во время и после обработки KCl. Красные и синие линии обозначают нейроны C1 и B2 соответственно. Шкала шкалы 10 с.
е. 6, 24, 36, 48, 54, 72 часа после нанесения покрытия).В первом столбце показано развитие ветвлений нейритов (масштабная полоса 200 мкм). Три столбца растровых графиков показывают одну минуту электрофизиологической активности непосредственно до, во время и после обработки KCl. Красные и синие линии обозначают нейроны C1 и B2 соответственно. Шкала шкалы 10 с. Дополнительный файл 1 показывает тренды как CV, так и частоты. Сети, обработанные KCl, никогда не проявляли квазипериодического поведения, так как CV всегда был больше 0.2.
Дополнительный файл 1 показывает тренды как CV, так и частоты. Сети, обработанные KCl, никогда не проявляли квазипериодического поведения, так как CV всегда был больше 0.2. На рис. 3A и B показаны тренды IFR нейронов C1 (красный) и B2 (синий). При сравнении тенденций IFR культур, обработанных KCl (рис. 3A) и 5-HT (рис. 3B), основным отличием было полное отсутствие электрофизиологической активности в нейронах C1 и B2 до стимуляции KCl.Напротив, 5-HT индуцировал низкочастотную (<5 Гц) базовую активность, особенно в клетках B2. Во время развития заметных различий замечено не было: в культурах, стимулированных KCl, мы наблюдали быстрое повышение активности сразу после стимуляции, которое длилось менее 1 минуты. Как в нейронах C1, так и в B2, IFR достиг максимального значения 20 Гц. В случае стимуляции 5-HT IFR после резкого увеличения оставался стабильным на протяжении всей фазы стимуляции. При разработке принципиальных отличий не наблюдалось.Нейроны C1 и B2 запускались очень регулярно: нейроны B2 запускались с более высокой частотой, чем C1, и эта активность сохранялась до вымывания. Впоследствии, после короткого переходного процесса (от 2 до 5 минут), характеризующегося периодом молчания, нейроны B2 спонтанно возобновили работу.
На рис. 3A и B показаны тренды IFR нейронов C1 (красный) и B2 (синий). При сравнении тенденций IFR культур, обработанных KCl (рис. 3A) и 5-HT (рис. 3B), основным отличием было полное отсутствие электрофизиологической активности в нейронах C1 и B2 до стимуляции KCl.Напротив, 5-HT индуцировал низкочастотную (<5 Гц) базовую активность, особенно в клетках B2. Во время развития заметных различий замечено не было: в культурах, стимулированных KCl, мы наблюдали быстрое повышение активности сразу после стимуляции, которое длилось менее 1 минуты. Как в нейронах C1, так и в B2, IFR достиг максимального значения 20 Гц. В случае стимуляции 5-HT IFR после резкого увеличения оставался стабильным на протяжении всей фазы стимуляции. При разработке принципиальных отличий не наблюдалось.Нейроны C1 и B2 запускались очень регулярно: нейроны B2 запускались с более высокой частотой, чем C1, и эта активность сохранялась до вымывания. Впоследствии, после короткого переходного процесса (от 2 до 5 минут), характеризующегося периодом молчания, нейроны B2 спонтанно возобновили работу.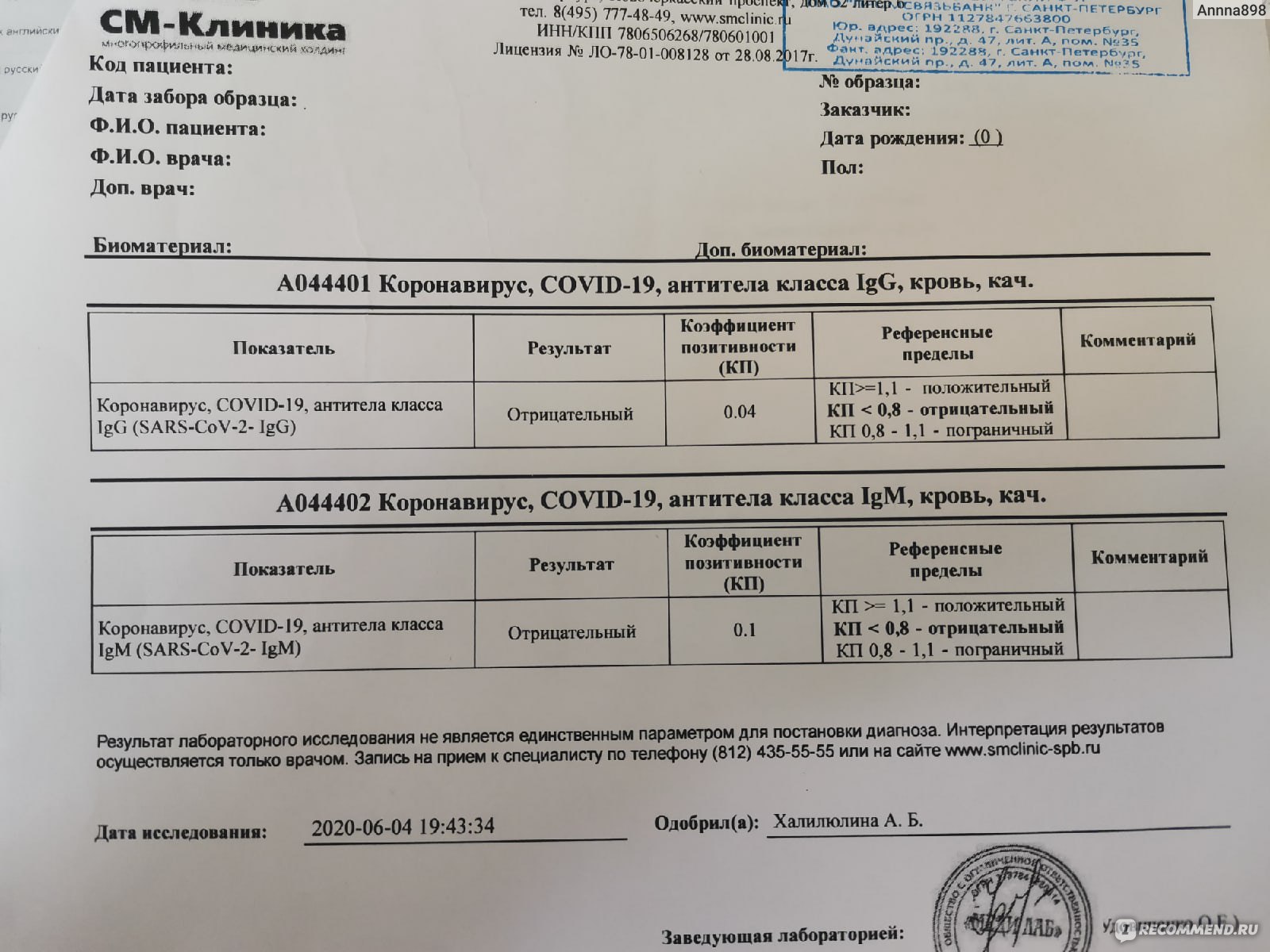 В этой постстимульной фазе динамика, демонстрируемая сетями, обработанными KCl, была более нерегулярной: нейроны C1 всегда находились в состоянии покоя во время развития, тогда как нейроны B2 демонстрировали пик активности в 48--й час .Затем IFR замедлился на 54 -й час до нуля на 72 -й час.
В этой постстимульной фазе динамика, демонстрируемая сетями, обработанными KCl, была более нерегулярной: нейроны C1 всегда находились в состоянии покоя во время развития, тогда как нейроны B2 демонстрировали пик активности в 48--й час .Затем IFR замедлился на 54 -й час до нуля на 72 -й час. Интересно, что значения MFR были статистически одинаковыми во время разработки (рисунки 3C и D), что позволяет предположить, что пиковая активность была стабильной, хотя возможности подключения к сети менялись и развивались (см., Рисунки 2, 4 и 7).
Интересно, что значения MFR были статистически одинаковыми во время разработки (рисунки 3C и D), что позволяет предположить, что пиковая активность была стабильной, хотя возможности подключения к сети менялись и развивались (см., Рисунки 2, 4 и 7). Фиг. 5C и D). Таким образом, сравнивая культуры, обработанные KCl и 5-HT, мы обнаружили статистически значимое различие в положении временного пика ISI (Kruskal-Wallis, непараметрический тест, P <0.01).
Фиг. 5C и D). Таким образом, сравнивая культуры, обработанные KCl и 5-HT, мы обнаружили статистически значимое различие в положении временного пика ISI (Kruskal-Wallis, непараметрический тест, P <0.01). К этим клеткам применяли те же процедуры культивирования и обработки, которые описаны для устройств MEA.Мы проанализировали как спонтанную, так и возбуждающую активность, вызванную стимулом деполяризации, примененным через 6 часов после нанесения покрытия, до обработки и вскоре после вымывания обработки (рис. 6А). Более того, те же клетки снова регистрировали через 24 часа после посева, чтобы проверить наличие долговременных эффектов. Как правило, через 6 часов после посева нейроны B2 проявляли низкочастотную спонтанную активность до лечения ( n = 8 в каждой группе; фигура 6B). Эти клетки сильно увеличили свою активность возбуждения после вымывания 20 мкМ серотонина, нанесенного в течение 10 минут, переключив их скорость возбуждения с 0.От 06 ± 0,06 до 0,72 ± 0,14 импульсов / с (против 0,12 ± 0,07 всплесков / с в контрольной группе; P <0,001, апостериорный тест Бонферрони ). После вымывания раствора с высоким содержанием KCl не наблюдалось значительных изменений, что подтверждает, что вымывание полностью снижает активность, индуцированную калием.
К этим клеткам применяли те же процедуры культивирования и обработки, которые описаны для устройств MEA.Мы проанализировали как спонтанную, так и возбуждающую активность, вызванную стимулом деполяризации, примененным через 6 часов после нанесения покрытия, до обработки и вскоре после вымывания обработки (рис. 6А). Более того, те же клетки снова регистрировали через 24 часа после посева, чтобы проверить наличие долговременных эффектов. Как правило, через 6 часов после посева нейроны B2 проявляли низкочастотную спонтанную активность до лечения ( n = 8 в каждой группе; фигура 6B). Эти клетки сильно увеличили свою активность возбуждения после вымывания 20 мкМ серотонина, нанесенного в течение 10 минут, переключив их скорость возбуждения с 0.От 06 ± 0,06 до 0,72 ± 0,14 импульсов / с (против 0,12 ± 0,07 всплесков / с в контрольной группе; P <0,001, апостериорный тест Бонферрони ). После вымывания раствора с высоким содержанием KCl не наблюдалось значительных изменений, что подтверждает, что вымывание полностью снижает активность, индуцированную калием. Те же клетки снова тестировали через 24 часа, и во всех экспериментальных группах не было обнаружено спонтанной активности. С другой стороны, нейроны C1 всегда были полностью безмолвными (рис. 6C).
Те же клетки снова тестировали через 24 часа, и во всех экспериментальных группах не было обнаружено спонтанной активности. С другой стороны, нейроны C1 всегда были полностью безмолвными (рис. 6C). Таким образом, мы можем сделать вывод, что нейроны C1 несут рецепторы, ответственные на серотонин, которые участвуют в регуляции их возбудимости без изменения их мембранного потенциала, как это наблюдается в гомологичной метацеребральной клетке Aplysia [20, 21].
Таким образом, мы можем сделать вывод, что нейроны C1 несут рецепторы, ответственные на серотонин, которые участвуют в регуляции их возбудимости без изменения их мембранного потенциала, как это наблюдается в гомологичной метацеребральной клетке Aplysia [20, 21]. Мы измерили количество нейритов, соединяющих нейроны в одном кластере (внутри кластера), и среди 4 разных кластеров плотность нейритов (между кластерами), чтобы оценить плотность нейритов. Первоначально данные, измеренные с помощью нейронов C1 и B2, анализировались отдельно: мы решили включить эти значения в одну группу, поскольку их темпы роста были очень похожи друг на друга.
Мы измерили количество нейритов, соединяющих нейроны в одном кластере (внутри кластера), и среди 4 разных кластеров плотность нейритов (между кластерами), чтобы оценить плотность нейритов. Первоначально данные, измеренные с помощью нейронов C1 и B2, анализировались отдельно: мы решили включить эти значения в одну группу, поскольку их темпы роста были очень похожи друг на друга. В частности, мы наблюдали статистически значимое снижение плотности внутрикластерных нейритов в цепях, обработанных 5-HT ( n = 12), которое началось с 24 часов и сохранялось в следующие моменты времени, достигая значения 0.029 ± 0,002 нейритов / мкм 2 по сравнению с 0,040 ± 0,002 нейритов / мкм 2 контрольной группы ( n = 12) через 72 часа ( P <0,001, апостериорный тест Бонферрони ) . И наоборот, нанесение раствора с высоким содержанием калия вызывало увеличение плотности нейритов с 0,051 ± 0,001 нейритов / мкм 2 , измеренных через 72 часа ( n = 8; P <0,001, апостериорный тест Бонферрони ). .
В частности, мы наблюдали статистически значимое снижение плотности внутрикластерных нейритов в цепях, обработанных 5-HT ( n = 12), которое началось с 24 часов и сохранялось в следующие моменты времени, достигая значения 0.029 ± 0,002 нейритов / мкм 2 по сравнению с 0,040 ± 0,002 нейритов / мкм 2 контрольной группы ( n = 12) через 72 часа ( P <0,001, апостериорный тест Бонферрони ) . И наоборот, нанесение раствора с высоким содержанием калия вызывало увеличение плотности нейритов с 0,051 ± 0,001 нейритов / мкм 2 , измеренных через 72 часа ( n = 8; P <0,001, апостериорный тест Бонферрони ). . Наоборот, статистически значимое снижение произошло после лечения 5-HT. Аналогичные результаты были получены с учетом того, что нейриты проецируются из одного кластера в другой (межкластерная плотность). В ). В то время как 5-HT вызывал заметное снижение, менее выраженное увеличение было обнаружено в сетях, обработанных KCl.( C ) Гистограмма скорости роста нейритов, показывающая, что применяемые обработки не вызывали дефектов роста.
Наоборот, статистически значимое снижение произошло после лечения 5-HT. Аналогичные результаты были получены с учетом того, что нейриты проецируются из одного кластера в другой (межкластерная плотность). В ). В то время как 5-HT вызывал заметное снижение, менее выраженное увеличение было обнаружено в сетях, обработанных KCl.( C ) Гистограмма скорости роста нейритов, показывающая, что применяемые обработки не вызывали дефектов роста. Мы обнаружили, что это усиление было значительно нарушено применением серотонина (то есть через 72 часа: 0,008 ± 0,002 нейритов / мкм 2 против 0,018 ± 0,003 нейритов / мкм 2 контрольной группы; P <0,001, Бонферрони апостериорный тест ).
Мы обнаружили, что это усиление было значительно нарушено применением серотонина (то есть через 72 часа: 0,008 ± 0,002 нейритов / мкм 2 против 0,018 ± 0,003 нейритов / мкм 2 контрольной группы; P <0,001, Бонферрони апостериорный тест ). е., KCl или 5-HT) модулируют функциональные связи, принимая во внимание доказательства того, что плотность нейритов увеличивается с помощью KCl и снижается с помощью 5-HT (см. Фигуры 7A и 7B).
е., KCl или 5-HT) модулируют функциональные связи, принимая во внимание доказательства того, что плотность нейритов увеличивается с помощью KCl и снижается с помощью 5-HT (см. Фигуры 7A и 7B). Из анализа FC мы не нашли никаких соответствующих межкластерных функциональных связей, даже если мы наблюдали некоторые дальнодействующие связи в морфологическом анализе (рис. 7B).Взаимодействие, измеренное с помощью CC, предполагает, что такие отдаленные нейроны функционально не связаны. Фактически, мы обнаружили среди межкластерных электродов: i) шумные и незначительные СС; ii) CC-пики попадают в ячейку с центром в нуле, что свидетельствует о случайной совместной активации [26].
Из анализа FC мы не нашли никаких соответствующих межкластерных функциональных связей, даже если мы наблюдали некоторые дальнодействующие связи в морфологическом анализе (рис. 7B).Взаимодействие, измеренное с помощью CC, предполагает, что такие отдаленные нейроны функционально не связаны. Фактически, мы обнаружили среди межкластерных электродов: i) шумные и незначительные СС; ii) CC-пики попадают в ячейку с центром в нуле, что свидетельствует о случайной совместной активации [26]. ( A ) Количество обнаруженных функциональных связей в культурах нейронов Helix , обработанных KCl (черная линия) и 5-HT (красная линия).( B ) Тенденция пиковых значений кросс-коррелограммы в процессе разработки (KCl черный, 5-HT красный). ( C ) Оценка синаптической задержки: в случае лечения 5-HT задержки всегда выше, чем соответствующие с KCl. ( D — E ) Схематические изображения внутриклеточных APs, зарегистрированных из пре- и постсинаптических клеток, связанных химическим ( A ) или электрическим ( B ) соединением. Первые производные сигналов показаны на нижних панелях.( F ) Гистограмма, показывающая средние синаптические задержки, измеренные в зависимости от типа соединения (химического и электрического) по сравнению с типом лечения (5-HT и KCl).
( A ) Количество обнаруженных функциональных связей в культурах нейронов Helix , обработанных KCl (черная линия) и 5-HT (красная линия).( B ) Тенденция пиковых значений кросс-коррелограммы в процессе разработки (KCl черный, 5-HT красный). ( C ) Оценка синаптической задержки: в случае лечения 5-HT задержки всегда выше, чем соответствующие с KCl. ( D — E ) Схематические изображения внутриклеточных APs, зарегистрированных из пре- и постсинаптических клеток, связанных химическим ( A ) или электрическим ( B ) соединением. Первые производные сигналов показаны на нижних панелях.( F ) Гистограмма, показывающая средние синаптические задержки, измеренные в зависимости от типа соединения (химического и электрического) по сравнению с типом лечения (5-HT и KCl). Таким образом, чтобы охарактеризовать функциональные связи, мы оценили для всех культур и в процессе их развития прочность (т.е., пиковое значение кросс-коррелограммы) и задержка (то есть разница во времени между возникновением пика кросс-коррелограммы и нулем).
Таким образом, чтобы охарактеризовать функциональные связи, мы оценили для всех культур и в процессе их развития прочность (т.е., пиковое значение кросс-коррелограммы) и задержка (то есть разница во времени между возникновением пика кросс-коррелограммы и нулем).