Приходный кассовый ордер пример заполнения
28 серпня 2021
Середній бал: 5 із 5
- Теми:
- РРО та касова дисципліна
- РРО на підприємстві
- Касова дисципліна на підприємстві
- Розрахунки за РРО
- Використання РРО
Автор : КУПЧИК Тетяна
головний редактор об’єднаної редакції Експертус Головбух
Каждую расчетную операцию подтверждают расчетным документом. Один из них – приходный кассовый ордер. Все предприятия проводят расчеты за любой организационно-правовой формы и системы налогообложения, оформляют приходный кассовый ордер. Чтобы избежать штрафов от органов контроля, важно правильно их заполнять.
Один из них – приходный кассовый ордер. Все предприятия проводят расчеты за любой организационно-правовой формы и системы налогообложения, оформляют приходный кассовый ордер. Чтобы избежать штрафов от органов контроля, важно правильно их заполнять.
- Приходный кассовый ордер порядок заполнения
- Приходный кассовый ордер образец заполнения
- Приходный кассовый ордер бланк
Оформляйте приходный кассовый ордер, когда принимаете наличные в кассу. Во время его заполнения (табл.) руководствуйтесь требованиями Положения № 148.
НА ЗАМЕТКУ! В случае выдачи наличности по расходным ведомостям, электронными платежными средствами, сдача наличных в банк, получение наличных из банка по чеку и оприходование ее в кассе ПКО или РКО оформляется на общую сумму проведенных предприятием операций. В таком случае в РКО не заполняются реквизиты: «Получил», «Дата», «Сумма», «Подпись получателя», данные документа, удостоверяющего личность получателя (которые заполняет получатель наличности), а в ПКО — «Принято от» (п. 32 Положения № 148). Другие реквизиты в кассовых ордерах – обязательны к заполнению.
32 Положения № 148). Другие реквизиты в кассовых ордерах – обязательны к заполнению.
Приходный кассовый ордер порядок заполнения
Реквизит | Порядок заполнения реквизитов |
Приходный кассовый ордер № | Проставьте номер документа согласно записи, в Журнале регистрации приходных и расходных кассовых ордеров (далее — Журнал). Нумеруйте приходные и расходные кассовые ордера подряд, чтобы избежать повторов, или через дробь. Сквозную нумерацию продолжайте, даже если в течение года закончилась кассовая книга (ВИР, категория 109.10) |
№ п/п | Так как приходный кассовый ордер оформляют на каждую операцию по приему наличных, поэтому в реквизите «№ п/п» следует проставлять «1» (см. письма НБУ от 12.06.2018 № 50-0007/32326, от 14.06.2018 № 50-0007/32822) |
Дата | Укажите дату приема наличных в кассу. |
Корреспондирующий счет, субсчет | Укажите номер соответствующего счета (субсчета), который корреспондирует по кредиту с дебетом счета 301 «наличные в национальной валюте». Например, 311, 361, 372 и т. д. |
Код аналитического счета | Заполняйте только тогда, когда ведете соответствующую аналитику по корреспондирующим субсчетам используете в учете внутреннюю систему кодирования целевого назначения средств. Обычно эти ячейки оставляют пустыми |
Код целевого назначения | |
Сумма | Впишите фактически полученную сумму средств: гривны – словами, копейки – цифрами. Если предприятие является плательщиком НДС, укажите здесь сумму с НДС (ВИР, категория 109.15). |
Сумма цифрами | Впишите цифрами поступившую сумму наличных (в гривне с копейками) |
Принято от | Приведите информацию о лице, от которого приняли наличные. |
Основание | Укажите основание для оприходования средств (источник происхождения). Например, оприходование выручки, оказание услуг согласно договору, возврат денежных средств после командировки, приказ руководителя, поступление наличных из банка и тому подобное. Если оформляете поступление наличных из банка, также укажите номер и дату чека |
Приложения | Запишите документы, которые прилагаете к приходному кассовому ордеру и которые являются основанием внести наличные в кассу. Например, накладная, отчет об использовании средств, выданных на командировку или под отчет, акт выполненных работ/оказанных услуг и т. п |
Главный бухгалтер | Подписывает главный бухгалтер или уполномоченное руководителем лицо (п. |
Получил кассир | Если в штатном расписании нет должности кассира, его обязанности может выполнять другое лицо по распоряжению руководителя. Это может быть и сам руководитель, если на предприятии нет других работников (письмо НБУ от 14.02.2012 № 11/117/708-1645) |
М. П. | Проставьте оттиск печати предприятия. Однако делать это не обязательно. Печать ставят только на квитанции к приходному ордеру (!) |
Приходный кассовый ордер образец заполнения
СКАЧАТЬ ОБРАЗЕЦ ⤵️
Приходный кассовый ордер бланк
СКАЧАТЬ БЛАНК ⤵️
Статті за темою
Фискальный кассовый чек на товары (услуги)
Заявление о регистрации регистратора расчетных операций (форма № 1-РРО)
Стаття підготовлена за матеріалами журналу «Головбух»
Как заполнить приходный кассовый ордер? — КорпХантер — юридические консультации по вопросам коммерческого права
Приходный кассовый ордер
Форма Приходного Кассового Ордера ( КО-1), относится к первичным документам бухгалтерского учета.
Предназначение формы КО-1
Форма КО-1 предназначается, для того, чтобы правильно оприходовать поступившие денежные средства в кассу предприятия. Любые разновидности денежных средств могут поступать в кассу как от физических лиц, так и от организаций, оплаченные за товар или оказанные услуги. Выписывается этот ордер в 1 экземпляре и регистрируется в кассовой книге форма КО-3.
- Законодательная база ↓
- Кто должен заполнять приходный кассовый ордер? ↓
- Как заполнять приходный кассовый ордер? ↓
- Инструкции по заполнению КО-1: ↓
- Учет и хранение ↓
- Допущена ошибка, что делать? ↓
- Заполнение ПКО онлайн и в электронном виде ↓
Законодательная база
Форма этого документа КО-1, была утверждена Госкомстатом России и согласована с Министерством финансов, основываясь на постановление об утверждении документации по учету кассовых операций за №88 от 18.08.1998.
Основные правила заполнения первичных документов с 1. 01.2013 прописаны в статье № 9 от 6 декабря 2011 пункт № 402 «ФЗ О бухгалтерском учете». В этой статье говорится о том, что каждая хозяйственная операция должна подтверждаться документально. При создании и заполнении таких документов необходимо знать много нюансов и четко следовать законным правилам.
01.2013 прописаны в статье № 9 от 6 декабря 2011 пункт № 402 «ФЗ О бухгалтерском учете». В этой статье говорится о том, что каждая хозяйственная операция должна подтверждаться документально. При создании и заполнении таких документов необходимо знать много нюансов и четко следовать законным правилам.
Кто должен заполнять приходный кассовый ордер?
ПКО заполняется бухгалтером, кассиром или уполномоченным сотрудником (утвержденным письменным приказом руководителя).
Как заполнять приходный кассовый ордер?
- Этот документ создается и распечатывается в одном экземпляре, затем подписывается кассиром и главным бухгалтером. Если в компании главный бухгалтер не предусмотрен, то документ подписывает сам директор предприятия или его заместитель (на основании оформленного приказа).
- Документ обязательно заверяется печатью организации. Не забудьте, что печать должна содержать полное название организации, например: Товарищество с Ограниченной Ответственностью Весна и так далее.

- Квитанцию или как его еще называют корешок от приходно-кассового ордера, заполняют и отдают на руки тому лицу, которое внесло денежные средства в кассу, а сам ордер оставляют в бухгалтерии.
- Все приходные ордера нумеруются по порядку, началом послужит дата 1 января текущего года и так до конца года.
[box type=»download»] Следует помнить и о том, что никакие поправки или изменения в этом документе недопустимы, а сам ордер выписывается сразу же после получения наличных.[/box]
Инструкции по заполнению КО-1:
- В графе организация – указываем наименование вашего предприятия.

- В графу ОКПО вносится код, присвоенный горстатом. Если этот код не присвоен, в этой графе ничего не проставляется, кроме прочерка.
- Структурное подразделение – это такое внутреннее наименование отдела, в котором формируется этот документ КО-1.
- Номер документа – указание № приходно-кассового ордера. Нумерация должна быть последовательной.
- Дата составления – обозначаем дату выписки созданного документа. Обе даты по оформлению и взносу наличных должны совпадать.
- Дебет – необходимо поставить бухгалтерский счет 50.1 «Касса». Дебет счета 50.1 означает, что денежные средства поступили в кассу.
- Код структурного подразделения – присвоенный код, на который оформляются наличные средства, например, АУП.
- Корреспондирующий счет/ субсчет – ставится кредитовый бухгалтерский счет. Это следующие счета бухгалтерского учета:
- 51 счет означает, что деньги в кассу поступили из банка с нашего расчетного счета.
- 71 счет это возврат не использованных подотчетных денег.

- 73 счет возврат денег в случае недостачи.
- 91 счет ставится при выявленных излишках в кассе.
- 66 счет означает возврат заемных средств.
- 90-1 счет ставится при продаже товаров или оказании услуг за наличный расчет.
- 75 счет внесение денег учредителями для пополнения уставного капитала.
- Код аналитического учета – обозначает внутреннюю аналитику счета.
- Сумма в таблице – указывается та сумма, которую внесли при оплате. Эта сумма проставляется цифрами.
- Принято — от пишем название организации, или указываем фамилию физического лица, которые внесли деньги в кассу.
- Основание – указываем, за что мы получили деньги. Например: за проданный товар, или на увеличение уставного капитала, получение денег для последующей выплаты заработной платы и т. д.
- Сумма (прописью) – прописывается сумма с самого начало строки и с заглавной буквы, причем сокращение денежного эквивалента недопустимо.
- В том числе – в этой строке указывается сумма НДС, заполняется цифрами (только в том случае если предприятие является плательщиком НДС если не является, то указывается без НДС).

- Приложение – подкрепляем список документов и указываем дату и номер всех документов.
[box type=»download»] Скачать образец в формате Word-файла (.doc.)[/box]
Обязательные реквизиты для заполнения следующие:
- Код ОКУД
- Код ОКПО
- Номер документа
- Дата составления
- Корреспондирующий счет, субсчет
- Сумма
- Принято от
- Основание
- Подписи главного бухгалтера и кассира
[box type=»download»] Код по ОКПО и ОКУД можно найти в реестре ГоскомСтата.[/box]
Учет и хранение
Все кассовые документы, в том числе и приходно-кассовые ордера, учитывают ежедневно. Они все должны стоять в правильном порядке и нумерации, например: ПКО № 1,2,3 и так далее, затем пойдут РКО № 1,2,3 и так за весь день.
Также процедура будет и в последующие дни до конца года. В конце года все эти документы прошиваются в один документ, под названием Кассовая книга.
На обороте сшитой книги ставят сургучную печать или проклеивают бумажным листиком место прошивки. Поверх приклеенного листа ставят печать организации, пишут количество страниц и визируют подписью руководителя и главного бухгалтера.
Поверх приклеенного листа ставят печать организации, пишут количество страниц и визируют подписью руководителя и главного бухгалтера.
[box type=»download»] Все кассовые документы следует хранить не менее пяти лет.[/box]
Допущена ошибка, что делать?
Для начала давайте рассмотрим, какие чаще всего ошибки происходят при заполнении формы КО-1:
- Не заполнено название организации.
- Не проставлен или исправлен номер кассового ордера, неправильная нумерация с начала периода.
- Ошибочно указанная дата или ее отсутствие.
- Неправильно отражены бухгалтерские счета.
- Отсутствует подпись бухгалтера или печать организации.
- Нет росписи получателя денежных средств.
Если во всех этих случаях были допущены ошибки и вы сразу их обнаружили, то приходный кассовый ордер КО-1 необходимо будет переделать, за тем же номером и датой. Помните, что наличие грубых ошибок, исправлений и подчисток быть не должно.
При исправлении тех или иных данных в кассовой книге, необходимо делать аккуратно, зачеркнув тонкой черточкой, все изменения написать сверху, а снизу подписать “исправлено на …”.
Заполнение ПКО онлайн и в электронном виде
Для юридических лиц больше всего подойдет электронный вид заполнения этого документа. Самым оптимальным вариантом будет установка программы 1С. В этой программе имеются уже готовые шаблоны всех документов, вам только останется занести все данные предприятия и сформировать аналитику.
В последующем при заполнении приходного кассового ордера вам не надо будет вносить: названия предприятия, ОКПО, ОКУД. Что касается даты и нумерации, программа автоматически будет их проставлять. Эта программа значительно сократит ваше время и не даст запутаться в порядковых номерах.
[box type=»download»] Если вы физическое лицо или индивидуальный предприниматель, то вы можете воспользоваться, уже готовыми бланками, скачав их из интернета, а также обратиться за онлайн-помощью.[/box]
Сегодня очень много компаний предлагают такие услуги через интернет. В первом случае, если вы скачаете бланк, вам придется заполнять его самостоятельно и постоянной следить за нумерацией, датой и правильностью заполнения остальных граф.
В первом случае, если вы скачаете бланк, вам придется заполнять его самостоятельно и постоянной следить за нумерацией, датой и правильностью заполнения остальных граф.
Если же вы обратитесь за онлайн-помощью, то вам подробно все расскажут, как и что необходимо заполнить, а возможно и заполнят все за вас. Только скорей всего эта услуга будет платной.
Приходный кассовый ордер: порядок заполнения :: SYL.ru
Актуально для выпечки с несладкой начинкой: ошибка в рецепте дрожжевого теста
Чтоб цвели пышно. Как посадить осенью тюльпаны
Идеально впишется в осень 2022: в тренде окрашивание в оттенке Dishwater Blonde
Модное окрашивание 2023: лучшие оттенки с омолаживающим эффектом
Хлеб — хороший «сосед»: как увеличить срок хранения печенья
Утепление растений и не только: как использовать опавшие листья с пользой
Специальный мешок или ручная стирка. Как лучше стирать бюстгальтер
Как лучше стирать бюстгальтер
Улыбайтесь каждый день от всего сердца: духовные ритуалы для повышения энергии
Больше пилингов с агрессивными кислотами: 5 правил осеннего ухода за кожей
«У нас интересная история знакомства»: Юлия Беретта готовится к свадьбе
Автор Анна Селезнева
Где применяется ПКО
Независимо от организационно-правовой формы, каждое предприятие обязано вести бухгалтерский и налоговый учет. От распоряжений руководства и выбранной системы (УСН, ЕНВД, КСНО) зависит полнота его ведения. В любом случае основанием для внесения бухгалтерской информации в отчетность являются задокументированные хозяйственные операции. Приходный кассовый ордер является первичным бухгалтерским документом, отражающим движение денежных средств в кассе предприятия. Все организации, осуществляющие операции с наличностью, обязаны фиксировать перемещение средств по счету 50 «Касса». Для поступления конкретных сумм применяют приходные кассовые ордера, для расходных операций – расходные. Параллельно для учета наличности устанавливается ККМ. Данные учета по активному балансовому счету 50 и журнала регистрации кассовых чеков должны быть сопоставимы на конец каждого рабочего дня.
В любом случае основанием для внесения бухгалтерской информации в отчетность являются задокументированные хозяйственные операции. Приходный кассовый ордер является первичным бухгалтерским документом, отражающим движение денежных средств в кассе предприятия. Все организации, осуществляющие операции с наличностью, обязаны фиксировать перемещение средств по счету 50 «Касса». Для поступления конкретных сумм применяют приходные кассовые ордера, для расходных операций – расходные. Параллельно для учета наличности устанавливается ККМ. Данные учета по активному балансовому счету 50 и журнала регистрации кассовых чеков должны быть сопоставимы на конец каждого рабочего дня.
Бланк ПКО
Приходный кассовый ордер заполняется в строгом соответствии с формой, утвержденной Госкомстатом РФ 18 августа 1998 года, постановлением № 88. Унифицированная форма КО-1 используется для автоматизированной системы учета и заполнения вручную. Единый бланк ПКО состоит из двух частей, содержащих однозначное подтверждение факта внесения наличных средств. Отрывной частью является квитанция, которая оформляется для подтверждения внесения определенной суммы физическим лицом. Информация, содержащаяся в ней, подтверждается подписями главного бухгалтера и кассира, принявшего денежные средства. Обязательным условием достоверности документа является печать на приходном кассовом ордере: большая часть оттиска располагается на квитанции, но обязательно небольшой фрагмент должен отпечататься на ПКО. Основная часть ордера остается в организации, заверяется подписями кассира, руководителя (в случае отсутствия бухгалтерии), главного бухгалтера или сотрудника, имеющего право подписи на основании приказа. ПКО является документом, в котором не допускаются исправления, поэтому его заполнение должно полностью соответствовать утвержденным стандартам и отражать достоверные данные.
Отрывной частью является квитанция, которая оформляется для подтверждения внесения определенной суммы физическим лицом. Информация, содержащаяся в ней, подтверждается подписями главного бухгалтера и кассира, принявшего денежные средства. Обязательным условием достоверности документа является печать на приходном кассовом ордере: большая часть оттиска располагается на квитанции, но обязательно небольшой фрагмент должен отпечататься на ПКО. Основная часть ордера остается в организации, заверяется подписями кассира, руководителя (в случае отсутствия бухгалтерии), главного бухгалтера или сотрудника, имеющего право подписи на основании приказа. ПКО является документом, в котором не допускаются исправления, поэтому его заполнение должно полностью соответствовать утвержденным стандартам и отражать достоверные данные.
Порядок заполнения ПКО
Заполнению ПКО стоит уделить особое внимание, ведь кассир несет материальную ответственность за содержимое кассы и достоверность документов, которые подписывает. Так же тщательно приходный кассовый ордер проверяет главный бухгалтер предприятия, т. к. при некорректном заполнении корреспонденции счетов контрагентов ошибка отражается во всех регистрах бухгалтерского, управленческого и налогового учета. Заполнение ПКО происходит поэтапно, с первой строки бланка, в следующей последовательности.
Так же тщательно приходный кассовый ордер проверяет главный бухгалтер предприятия, т. к. при некорректном заполнении корреспонденции счетов контрагентов ошибка отражается во всех регистрах бухгалтерского, управленческого и налогового учета. Заполнение ПКО происходит поэтапно, с первой строки бланка, в следующей последовательности.
Пошаговая инструкция заполнения ПКО
- Наименование организации. В данной строке указывается правовая форма предприятия и его наименование, которое должно соответствовать данным ЕГРЮЛ в полном или сокращенном виде. Структурное подразделение организации прописывается в случае его наличия, иначе ставится прочерк.
- Порядковый номер документа заносится в соответствии с журналом регистрации ПКО, который формируется с начала календарного года.
- В графу дата вписывается число фактического прихода средств, формат записи стандартный для документов ДД. ММ. ГГГГ.
- Ячейки для указания корреспондирующих счетов могут быть заполнены не кассиром, а бухгалтером, который производит дальнейшее отражение данной информации по счетам и регистрам бухгалтерского учета.
 В строке «Дебет» отражается счет 50 «Касса», возможно использование валютной кассы или аналитического субсчета, прописанного в учетной политике предприятия. Для заполнения строки «Кредит» необходимо знать источник поступления средств.
В строке «Дебет» отражается счет 50 «Касса», возможно использование валютной кассы или аналитического субсчета, прописанного в учетной политике предприятия. Для заполнения строки «Кредит» необходимо знать источник поступления средств. - Сумма, полученная в кассу, прописывается цифрами с указанием копеек.
- Следующая графа заполняется в случае использования на предприятии кодов назначения; если данная информация не прописана в учетной политике, то ставится прочерк.
- Далее прописывается, от кого принята указанная сумма. При внесении средств сотрудником компании записывается его фамилия и инициалы; если сумму вносит физическое лицо, представляющее стороннюю фирму, то необходимо указывать полное название организации контрагента, а данные физического лица и номер его доверенности можно указать в приложении.
- Основанием для поступления наличных средств может быть договор с контрагентом, распоряжение руководителя организации, авансовый отчет и т. д., в зависимости от источника поступления.

- Сумма прописью, копейки можно писать цифрами. При заполнении данной строки свободное от текста поле обязательно маркируется прочерком, для исключения возможности дописки.
- При работе предприятия с НДС его сумма указывается в строке «В том числе»; если налог не платится или не включен в данную сумму, ставится прочерк либо пишется «Без НДС».
- В приложении указываются дополнительные документы, например, номер и дата доверенности на сотрудника другой организации, номер отгрузочного документа, который оплачивает покупатель, дата и номер приказа о возмещении сотрудником ущерба и т. д. Квитанция ПКО должна полностью дублировать информацию, содержащуюся в ордере. После заполнения она отрывается и передается лицу, внесшему денежные средства, иногда возможно подтверждение поступления наличности при помощи кассового чека (если предприятие имеет ККМ). Бланк приходно-кассового ордера в бухгалтерских программах идентичен типографским бланкам, так же аналогичен порядок их заполнения.

Основные источники поступления наличных в кассу
- Расчетный счет предприятия.
- Частичная или полная оплата от покупателей.
- Возврат подотчетной суммы.
- Поступление средств от прочих дебиторов и кредиторов.
- Средства, полученные от филиалов/подразделений.
- Возврат выданной сотруднику ссуды.
- Сумма, излишне уплаченная поставщикам.
- Погашение задолженности, возникшей в результате проведения инвентаризации и т. д.
Кто вправе подписывать приходный кассовый ордер
Все кассовые документы, в том числе и ПКО, имеют право подписывать, на основании Положения-373 П, следующие лица:
- главный бухгалтер;
- бухгалтер, имеющий право подписи на основании приказа;
- кассир;
- руководитель предприятия.
Заполнять бланк имеет право любой бухгалтер. Кассир подписывает документ после получения указанной суммы в кассу организации и тщательной проверки заполнения документа. При отсутствии в штате бухгалтера или его временном отсутствии на рабочем месте, оформить и подписать кассовый ордер может руководитель предприятия.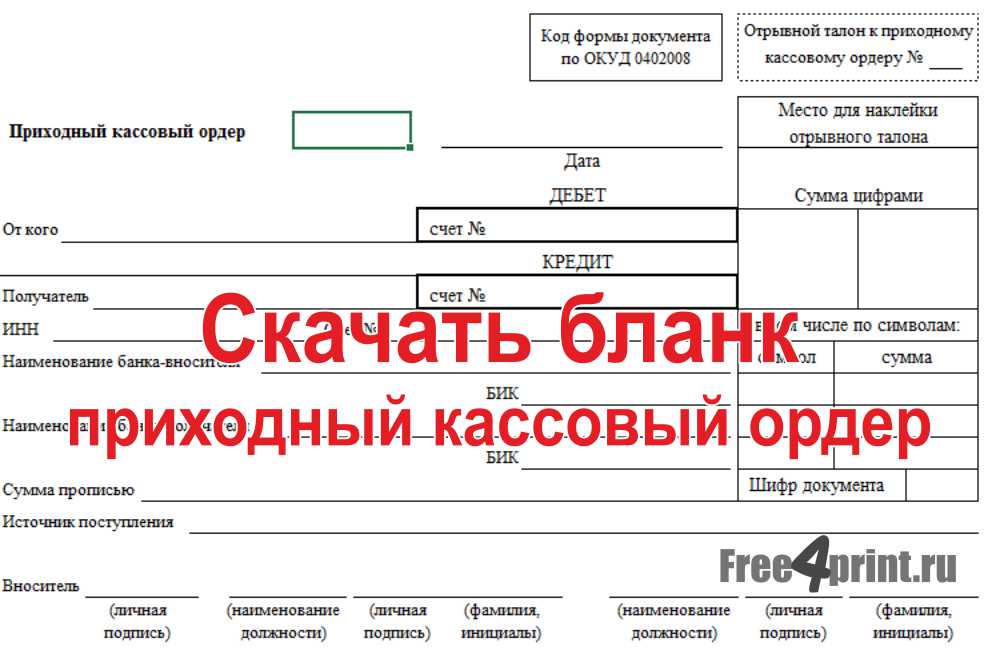
Движение ПКО по регистрам бухгалтерского учета
ПКО после проведения находит отражение в кассовой книге, которая заполняется кассиром ежедневно. Для сверки всех полученных за день кассовых документов с фактическим наличием в кассе предприятия средств кассир и ведет данную книгу. При оформлении очередного листа в него вносятся данные обо всех приходных кассовых ордерах и расходниках. На начало каждого дня записывается остаток по кассе, который в конце дня пересчитывается с учетом всех поступлений и расхода. Контроль над своевременным внесением записей в кассовую книгу и достоверностью отраженной информации осуществляет главный бухгалтер или руководитель предприятия, который подписывает каждый лист кассовой книги.
ПКО в автоматизированном учете
При применении предприятием автоматизированной системы учета, что в настоящее время является правилом, а не исключением, значительно упрощается процесс заполнения ПКО. Программы, при помощи которых организации ведут бухгалтерский, управленческий и налоговый учет позволяют в автоматическом режиме заполнять большую часть документации. Каждый заполненный в программе документ проводится (проходит по всем соответствующим регистрам) и распечатывается. При использовании специализированных программ значительно снижается возможность некорректного заполнения не только кассовых, но и всех бухгалтерских бланков.
Каждый заполненный в программе документ проводится (проходит по всем соответствующим регистрам) и распечатывается. При использовании специализированных программ значительно снижается возможность некорректного заполнения не только кассовых, но и всех бухгалтерских бланков.
Похожие статьи
- День главного бухгалтера в России
- Что такое кассовая книга?
- Бухгалтерский учет кассовых операций и его организация. Учет кассовых операций банка
- Денежные средства — это… Денежные средства организации. Учет денежных средств
- Краткая информация по статье бухгалтерского учета «Учет расчетов с подотчетными лицами»
- Сроки хранения документов в организации: это важно знать
- Инвентаризация кассы: что нужно знать бухгалтеру?
Также читайте
Что такое выполнение заказа? 5 способов улучшить процесс
Свяжитесь с экспертом по выполнению заказов сегодня.
 Начало работы
Начало работыЧему вы хотите научиться?
Как выполнять заказы
Улучшение процесса выполнения
Цены на выполнение запросов от ShipBob
Пандемия COVID-19 фактически продвинула электронную торговлю примерно на 5-15 лет. Переход от офлайн к онлайн привел к большому спросу на складские помещения для электронной коммерции и связанные с ними рабочие места. С этим изменением многие предприятия, которые не привыкли упаковывать и доставлять заказы клиентам, должны были научиться.
Эффективное выполнение заказов — один из важнейших факторов устойчивого развития электронной коммерции. Наличие правильных процессов для точного и быстрого выполнения заказов может улучшить качество обслуживания клиентов.
При неэффективном процессе выполнения заказов затраты на выполнение могут возрасти, клиенты могут расстроиться или разочароваться, и это может даже значительно снизить пожизненную ценность клиента (LTV).
По мере увеличения объема заказов процесс их выполнения может стать более сложным и трудоемким. К счастью, есть способы повысить эффективность выполнения заказов, чтобы ускорить процесс и свести к минимуму количество ошибок.
В этой статье мы рассмотрим весь процесс оформления заказа и поделимся советами, как оптимизировать процесс выполнения заказа для более быстрой доставки.
Что такое исполнение заказа?
Выполнение заказа относится к задачам, выполняемым исполнителем заказа, включая получение и размещение запасов, сбор и упаковку коробок, а также отправку заказов из распределительного центра или склада.
Процесс выполнения заказа в 5 шагов
В процесс выполнения заказа входит гораздо больше, чем просто упаковка заказа и отправка его за дверь. Наполнитель заказа может участвовать в каждом этапе процесса выполнения заказа, от получения инвентаря до выбора и извлечения товаров, или быть узкоспециализированным в одной конкретной области.
Если все этапы процесса выполнения заказа не выполнены точно, заказ не будет доставлен в соответствии с ожиданиями клиента.
Вот пять основных шагов, необходимых для выполнения заказа.
1. Склад получает запасы
Вы не можете выполнять заказы без запасов электронной торговли. Поставщик, производитель или бренд электронной коммерции должны отправить необходимые продукты на ваш склад, где сотрудники получат посылки. Термин «получение» относится к приему входящего инвентаря для хранения перед его продажей. На этом этапе специалист по оформлению заказа удостоверится, что все отправленные товары доставлены и находятся в хорошем состоянии.
Если вы работаете со сторонней логистической компанией (3PL), такой как ShipBob, у них будет свой собственный процесс для обеспечения учета всех запасов.
Например, ShipBob требует, чтобы продавцы заполнили заказ на приемку на склад (WRO) и прикрепили соответствующие этикетки к каждой коробке. Это помогает им заранее знать, чего ожидать, и ускорить процесс получения при управлении запасами для тысяч клиентов.
«Отправить инвентарь на ШипБоб было легко. Наша первая партия инвентаря была получена ShipBob и готова к отправке на следующий день. Через девять дней после того, как мы начали работу с командой реализации ShipBob, мы отправляли заказы».
Тим Финк, соучредитель EnduroSport
2. Инвентаризация складских запасов
На этом этапе товары хранятся на полках склада, содержащих другие единицы той же SKU, так как каждый уникальный продукт должен иметь отдельный выделенный место хранения (или партии продукции, требующие хранения партии до истечения срока годности или в случае отзыва продукции).
Наиболее распространенные места хранения инвентаря включают полку, корзину или поддон. Надлежащее складирование является одной из наиболее важных частей правильного выполнения заказа, и товары должны храниться в надлежащих условиях
«ShipBob обеспечивает условия хранения, необходимые для обеспечения безопасного и эффективного хранения и доставки наших продуктов питания высочайшего качества нашим клиентам».

Пабло Габатто, менеджер по бизнес-операциям компании Ample Foods
3. Поиск и комплектация товаров
После размещения заказа в вашем магазине начинается процесс комплектования на складе. Наполнитель заказа найдет товар (ы), чтобы весь заказ можно было упаковать на следующем этапе.
ShipBob — это 3PL с поддержкой технологий, поэтому их запатентованная система управления складом (WMS) автоматически назначает аналогичные заказы с запасами в той же области склада одному и тому же комплектовщику, чтобы сократить количество шагов, необходимых для выбора заказов, для более эффективного рабочего процесса. .
Автоматически создается список комплектации, который включает заказанные товары, количество и местонахождение каждого продукта в центре выполнения заказов. Каждая выбранная единица сканируется из контейнера инвентаря, поэтому количество инвентаря обновляется в режиме реального времени, предоставляя торговцам актуальные уровни запасов.
«С помощью ShipBob мы точно видим, что физически отобрано, и знаем, что заказ был выполнен, как и ожидалось. С нашим старым 3PL нам приходилось во всем полагаться на нашего представителя, и мы не могли быть самодостаточными. Им приходилось делать всю работу за нас, и мы не могли видеть, что собирали их складские сотрудники».
Джерард Экер, основатель и генеральный директор Ocean & Co.
4. Заказ надежно упакован
Когда все товары в заказе собраны, следующим шагом будет их надежная упаковка и добавление транспортной этикетки. Все товары должны быть отправлены в одной упаковке, если это возможно, чтобы избежать разделения доставки.
Например, в ShipBob стандартные упаковочные материалы, в том числе коричневые коробки, обычные пузырчатые почтовые пакеты и полиэтиленовые пакеты, упаковочная лента и крепежные элементы, входят в комплект поставки без дополнительной оплаты.
Мы выбираем лучшие упаковочные материалы для каждого заказа, чтобы защитить вашу продукцию и добиться наименьшего практичного габаритного веса. Мы также позволяем нашим клиентам использовать нестандартные упаковочные материалы, чтобы разместить свой бренд в центре внимания.
Мы также позволяем нашим клиентам использовать нестандартные упаковочные материалы, чтобы разместить свой бренд в центре внимания.
«ShipBob должен быть в центре внимания компаний электронной коммерции, переживающих рост, чтобы они могли сосредоточиться на бренде и дизайне, а не на упаковке коробок. Я знаю, что ShipBob может оставаться нашим партнером по мере того, как мы будем расти еще больше — от расширения до дополнительных центров выполнения и распределения нашего инвентаря по стране до использования большего количества их возможностей — и все это при сохранении этого чувства партнера».
Карл Проч, соучредитель FLEO
5. Отправка заказов
Последним этапом оформления заказов является отправка заказа для доставки. Для небольших брендов, выполняющих заказы самостоятельно, это означает несколько поездок на почту.
Благодаря аутсорсингу выполнения заказов вам не придется беспокоиться о доставке заказов самостоятельно, поскольку партнеры 3PL с крупными перевозчиками договариваются о тарифах на доставку и заставляют их ежедневно забирать посылки, отсортированные каждой службой доставки.
Транспортные компании осуществляют доставку на последней миле, чаще всего автомобильным или воздушным транспортом. Вы должны убедиться, что в вашем магазине настроено правильное отслеживание заказов, чтобы клиенты могли следить за ходом их доставки.
«Нам нравится, что ShipBob действительно управляет своими центрами выполнения — они знают свои операции и очень четко об этом говорят. ShipBob, имеющий несколько локаций, также был для нас огромным. Хранение наших запасов в Чикаго и Лос-Анджелесе привело к экономии средств, поскольку мы отправляем товары из ближайших к покупателю мест».
Кортни Ли, основатель Prymal
6 советов по улучшению выполнения заказов
Оптимизация процесса выполнения заказов имеет решающее значение для повышения эффективности цепочки поставок. Вот несколько советов о том, как улучшить выполнение заказов для вашей компании.
1. Внимательно организуйте инвентарь
При организации инвентаря имейте в виду, что товары нужно будет собирать позже для выполнения заказов. Таким образом, вы должны организовать свой инвентарь таким образом, чтобы было легко найти желаемые предметы (например, размещая часто заказываемые предметы рядом друг с другом).
Таким образом, вы должны организовать свой инвентарь таким образом, чтобы было легко найти желаемые предметы (например, размещая часто заказываемые предметы рядом друг с другом).
2. Настройка маршрутов комплектования
Маршруты комплектования помогают заказать сборщику заказов поиск необходимого товара. Маршруты проложены с учетом зоны, высоты локаций и правил техники безопасности. Эти маршруты помогают сборщику склада определить, в каком направлении вести транспортное средство доставки. не могу продать. Например, ShipBob помогает бизнесу:
- Будьте в курсе уровня запасов с помощью программного обеспечения для управления запасами и интеграции с другими системами.
- Ошибки заказа лимита при надлежащем отслеживании запасов.
- Предотвратите дефицит с помощью инструментов прогнозирования запасов и возможности устанавливать точки повторного заказа.
4. Оптимизируйте свои процессы
Процесс выполнения заказов всегда можно улучшить, будь то более быстрое время обработки, более идеальные места выполнения и маршруты доставки, уменьшенные зоны доставки, улучшенное управление запасами и более точное прогнозирование спроса.
Это может сводиться к улучшению стимулов для персонала, смене смен, внедрению программного обеспечения, установке нового оборудования или изменению операционных процессов. Ознакомьтесь с другими идеями по оптимизации цепочки поставок здесь.
5. Автоматизируйте процесс выполнения заказов
Автоматизация процесса выполнения заказов повышает операционную эффективность, снижает количество ошибок, повышает точность заказов и ускоряет доставку.
Если все сделано правильно, автоматизация также может сэкономить исполнителям заказов значительное количество времени и денег за счет меньшего количества возвратов и возмещений. Автоматическая доставка влечет за собой автоматическую отправку заказов исполнителям заказов, заказ дополнительных запасов при достижении определенного уровня в наличии, отправку обновлений отслеживания клиентам и многое другое.
6. Сотрудничайте с 3PL
Управлять процессом выполнения заказов сложно, поэтому многие бренды рассматривают возможность партнерства со сторонним поставщиком логистических услуг, таким как ShipBob. ShipBob — ведущая 3PL-компания, которая обрабатывает для вас процесс выполнения заказов.
ShipBob — ведущая 3PL-компания, которая обрабатывает для вас процесс выполнения заказов.
Интегрированное программное обеспечение ShipBob подключается к вашей платформе электронной коммерции для автоматической отправки заказов исполнителям, предоставляя вам информацию обо всех наших операциях.
«Выбирать, упаковывать и печатать этикетки, а также управлять хранилищем очень сложно. Для нас было бы огромным стрессом делать это самостоятельно, но тот факт, что ShipBob позаботится обо всем, как об экономии средств, так и о времени, имеет неоценимое значение для нашего бизнеса».
Николай Палони, соучредитель солнцезащитных очков Ombraz
Обрабатывать заказы на собственном складе?
Чтобы правильно управлять выполнением заказов самостоятельно, вам потребуются правильные технологии и инфраструктура.
ShipBob предлагает лучшую в своем классе систему управления складом (WMS) для брендов, у которых есть собственный склад и которым требуется помощь в управлении запасами в режиме реального времени, сокращение ошибок при комплектации, упаковке и отгрузке, а также легкое масштабирование.
С Merchant Plus бренды могут даже использовать услуги ShipBob в любом из центров выполнения ShipBob в США, Канаде, Европе и Австралии, чтобы улучшить трансграничную доставку, снизить затраты и ускорить доставку.
Как 3PL автоматизируют процесс выполнения вашего заказа
3PL с поддержкой технологий, такой как ShipBob, может помочь вам упростить процесс выполнения вашего заказа, избавив вас от выполнения задач электронной коммерции. Сертифицированные и хорошо обученные исполнители заказов выполняют каждую задачу с несколькими проверками, чтобы обеспечить более высокий уровень точности заказа.
ShipBob хранит ваш инвентарь в любой комбинации центров выполнения заказов по всему миру.
«ShipBob был отличным партнером, когда мы выросли. Они помогают нам расширяться практически без дополнительных усилий с нашей стороны. Мы сосредоточены на развитии нашего бизнеса, и этого нельзя достичь, упаковывая заказы, отправляя коробки и имея дело с огромными перевозчиками, такими как FedEx и UPS.
Вот что освоил ШипБоб. Мы хотим сосредоточиться на взаимодействии с нашими клиентами, создании нашего сообщества, и ShipBob позволяет нам делать именно это».
Пабло Габатто, менеджер по бизнес-операциям компании Ample Foods
Заключение
Выполнение заказа — это трудоемкий процесс, состоящий из множества движущихся частей, что означает возможность возникновения ошибок, особенно если у вас нет нужной команды. ShipBob предлагает опыт, инфраструктуру и технологии выполнения, чтобы упростить процесс выполнения заказа для вас и предоставить необходимые вам услуги в зависимости от типа заказа.
«Мне потребовался бы целый день, чтобы упаковать и отправить около 30 заказов.
Если бы я хотел отправиться в путешествие, мне нужно было бы взять с собой принтер для этикеток, продукты и упаковочные материалы. Я оказался в отпуске, постоянно проверяя новые заказы и отправляя товар из багажника своей машины.
С момента перехода на ShipBob заказы моей компании увеличились более чем втрое, и теперь я могу проводить больше времени, рассматривая общую картину, а не занимаясь такими делами, как набивка конвертов целыми днями. Теперь я свободный.»
Анастасия Эллисон, основатель Kula Cloth
Свяжитесь с ShipBob, нажав кнопку ниже, чтобы узнать, как мы можем помочь, узнать цены и посмотреть, подходим ли мы для вашего бизнеса.
Цены на выполнение запросов
Часто задаваемые вопросы по выполнению заказов
Выполнение заказов является важным аспектом управления цепочкой поставок, поэтому важно хорошо понимать его, чтобы знать, чего ожидать на каждом этапе процесса. Вот некоторые из наиболее часто задаваемых вопросов, связанных с выполнением заказов.
Порядок заполнения 3d и 4s орбиталей
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 10838
На этой странице рассматриваются некоторые проблемы с обычным способом объяснения электронной структуры элементов d-блока, основанного на порядке заполнения d- и s-орбиталей. Способ, которым обычно обучают порядку заполнения орбиталей, дает вам простой способ разработки электронных структур элементов. Однако это вызывает проблемы, когда вы начинаете объяснять различные свойства переходных элементов. Эта страница более подробно рассматривает это и предлагает более точное объяснение, позволяющее избежать проблем.
Порядок заполнения орбиталей
Принцип ауфбау объясняет, как электроны заполняют низкоэнергетические орбитали (ближе к ядру) до того, как они заполняют более высокоэнергетические. Там, где есть выбор между орбиталями одинаковой энергии, они заполняют орбитали по отдельности, насколько это возможно (правила Хундса). Диаграмма (не в масштабе) суммирует энергии орбиталей до уровня 4p.
Там, где есть выбор между орбиталями одинаковой энергии, они заполняют орбитали по отдельности, насколько это возможно (правила Хундса). Диаграмма (не в масштабе) суммирует энергии орбиталей до уровня 4p.
Странность заключается в положении 3d-орбиталей, которые показаны на несколько более высоком уровне, чем 4s. Это означает, что первой заполнится 4s-орбиталь, за которой следуют все 3d-орбитали, а затем 4p-орбитали. Аналогичная путаница происходит на более высоких уровнях, с таким большим перекрытием между энергетическими уровнями, что 4f-орбитали не заполняются, например, после 6s.
До этого момента все было просто, но орбитали 3 уровня не все заполнены — уровни 3d еще не использовались. Но если вы вернетесь к энергиям орбиталей, вы увидите, что следующая орбиталь с наименьшей энергией — это 4s, так что она заполняется первой.
| К | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 | |
| Ca | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 |
Элементы d-блока
Рисунок 2: Периодическая таблица периодов 2-4.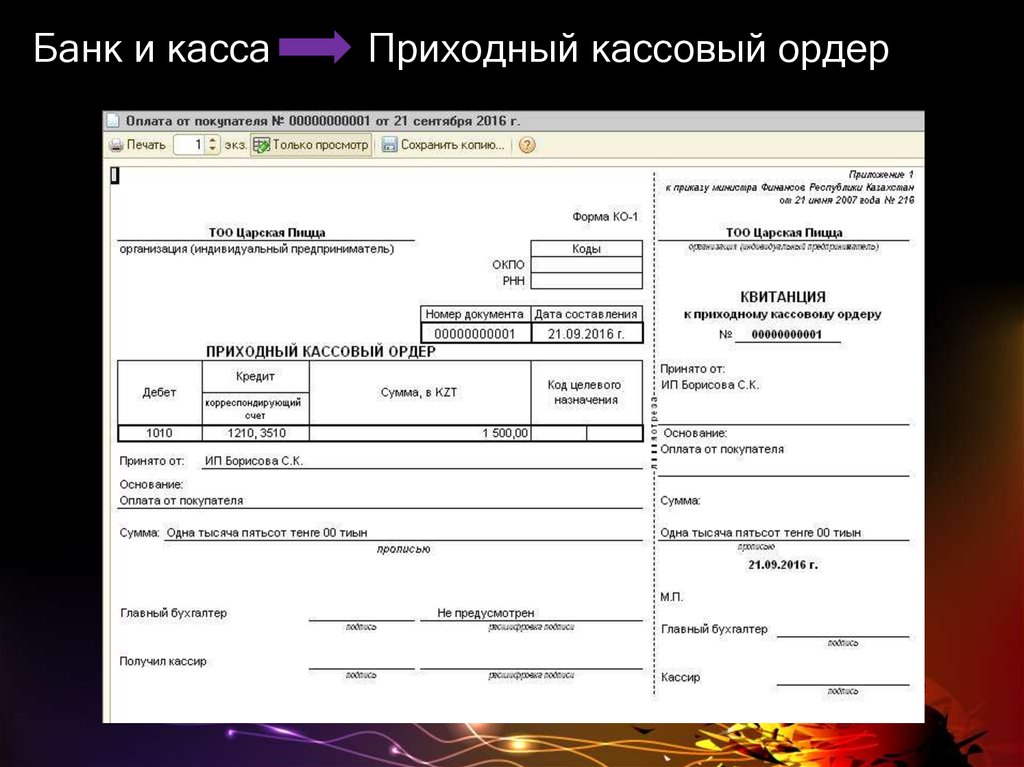 Элементы
Элементыd-блоков считаются элементами, в которых последний присоединяемый к атому электрон находится на d-орбитали (на самом деле это не так! Мы вернемся к этому подробно позже). Электронные структуры элементов d-блока показаны в таблице ниже. Каждый дополнительный электрон обычно переходит на 3d-орбиталь. Для удобства [Ar] используется для представления 1s 2 2s 2 2p 6 3s 2 3p 6 .
| Sc | [Ar] 3d 1 4s 2 |
| Ти | [Ар] 3d 2 4s 2 |
| В | [Ar] 3d 3 4s 2 |
| Кр | [Ar] 3d 5 4s 1 |
| Мн | [Ar] 3d 5 4s 2 |
| Fe | [Ар] 3d 6 4s 2 |
| Ко | [Ar] 3d 7 4s 2 |
| Никель | [Ar] 3d 8 4s 2 |
| Медь | [Ар] 3d 10 4с 1 |
| Цинк | [Ар] 3d 10 4s 2 |
ионы d-блока
Это, вероятно, самая неудовлетворительная вещь в этом подходе к электронным структурам элементов d-блока. Во всей химии переходных элементов 4s-орбиталь ведет себя как самая внешняя орбиталь с самой высокой энергией. Обратный порядок 3d- и 4s-орбиталей, по-видимому, применим только к в первую очередь создает атом . Во всех других отношениях 4s-электроны всегда являются электронами, о которых вам нужно думать в первую очередь.
Во всей химии переходных элементов 4s-орбиталь ведет себя как самая внешняя орбиталь с самой высокой энергией. Обратный порядок 3d- и 4s-орбиталей, по-видимому, применим только к в первую очередь создает атом . Во всех других отношениях 4s-электроны всегда являются электронами, о которых вам нужно думать в первую очередь.
Когда элементы d-блока (первый ряд) образуют ионы, первыми теряются 4s-электроны.
Пример \(\PageIndex{1}\): Железо
Рассмотрим электронную структуру нейтрального железа и железа (III). Чтобы записать электронную структуру для Fe 3 + :
- Fe: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
- Fe 3+ : 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5
Сначала теряются 4s-электроны, а затем один из 3d-электронов. Последнее, что касается образования ионов, явно неудовлетворительно.
Последнее, что касается образования ионов, явно неудовлетворительно.
- Мы говорим, что 4s-орбитали имеют меньшую энергию, чем 3d, и поэтому 4s-орбитали заполнены первый .
- Мы знаем, что при ионизации в первую очередь теряются 4s-электроны. Электроны, потерянные первыми, придут с самого высокого энергетического уровня, наиболее удаленного от влияния ядра. Таким образом, 4s-орбиталь должна иметь более высокую энергию, чем 3d-орбитали.
Эти утверждения прямо противоположны друг другу и не могут быть оба правильными.
При обсуждении энергии ионизации для этих элементов вы говорите о 4s-электронах, поскольку внешние электроны экранированы от ядра внутренними 3d-уровнями. Мы говорим, что первые энергии ионизации не сильно меняются в переходной серии, потому что каждый дополнительный 3d-электрон более или менее экранирует 4s-электроны от лишнего протона в ядре.
Объяснение энергий ионизации основано на том, что 4s-электроны имеют более высокую энергию и поэтому удаляются первыми.
Где ошибка в логике?
Обычный способ обучения этому — простой способ выяснить, какова электронная структура любого атома — с несколькими необычными случаями, такими как хром или медь. Проблемы возникают, когда вы пытаетесь воспринимать это слишком буквально. Это способ разработки структур — не более того. Недостаток заключается в диаграмме, с которой мы начали (рис. 1), и предположении, что она применима ко всем атомам. Другими словами, мы предполагаем, что энергии различных уровней равны всегда будет тем, что мы нарисуем на этой диаграмме. Если вы остановитесь и подумаете об этом, это должно быть неправильно.
По мере того, как вы перемещаетесь от элемента к элементу в Периодической таблице, к ядру добавляются протоны, а вокруг ядра — электроны. Различные притяжения и отталкивания в атомах неизбежно изменятся, когда вы это сделаете, и именно эти притяжения и отталкивания управляют энергиями различных орбиталей. Это означает, что студент должен переосмыслить это на основании того, что то, что мы нарисовали выше, равно 9.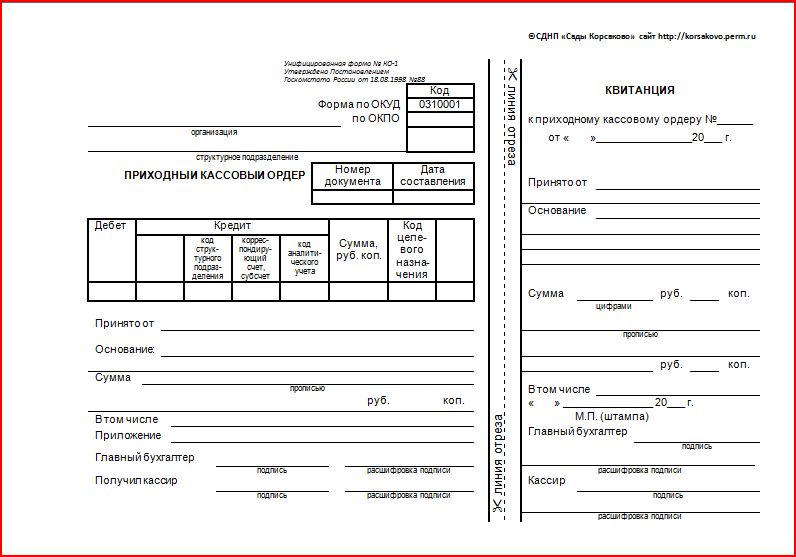 0009, а не , вероятно, будет выглядеть одинаково для всех элементов.
0009, а не , вероятно, будет выглядеть одинаково для всех элементов.
Решение
- Элементы до аргона: С ними проблем нет. Общий шаблон, который мы нарисовали на диаграмме выше, работает хорошо.
- Калий и кальций: Шаблон все еще работает здесь. Орбиталь 4s имеет меньшую энергию, чем орбиталь 3d, поэтому заполняется следующей. Это полностью соответствует химическому составу калия и кальция.
- Элементы крестовины: По причинам, которые слишком сложны для рассмотрения на этом уровне, как только вы доберетесь до скандия, энергия 3d-орбиталей станет немного на меньше , чем у 4s, и это остается верным для остальной части переходного ряда (следовательно , рисунок 1 неправильный, как нарисовано).
Таким образом, вместо того, чтобы определять электронную структуру скандия, представляя, что вы просто вбрасываете еще один электрон в атом кальция, причем электрон переходит на трехмерную орбиталь, поскольку 4s уже заполнена, вам действительно нужно более внимательно посмотреть на нее.
Помните, что в реальности от Sc до Zn меньшую энергию имеют 3d-орбитали, а не 4s.
Пример \(\PageIndex{2}\): скандий
Так почему же электронная конфигурация скандия не [Ar] 3d 3 , а не [Ar] 3d 1 4s 2 ?
Решение
Изготовление Sc 3 +
Представьте, что вы строите атом скандия из ящиков протонов, нейтронов и электронов. Вы построили ядро из 21 протона и 24 нейтронов и теперь добавляете электроны снаружи. Пока вы добавили 18 электронов, чтобы заполнить все уровни вплоть до 3p. По существу вы сделали ион Sc 3 + .
Создание Sc 2 +
Теперь вы собираетесь добавить следующий электрон, чтобы получить Sc 2 + . Куда пойдет электрон? 3d-орбитали скандия имеют меньшую энергию, чем 4s, поэтому следующий электрон перейдет на 3d-орбиталь. Структура [Ar] 3d 1 .
Структура [Ar] 3d 1 .
Создание Sc +
Можно ожидать, что следующий электрон также перейдет на 3d-орбиталь с меньшей энергией, что даст [Ar] 3d 2 . Но это не так. Здесь вам тоже есть о чем подумать. Если вы добавите еще один электрон к любому атому, вы неизбежно увеличите величину отталкивания. Отталкивание повышает энергию системы, делая ее энергетически менее стабильной. Очевидно, помогает, если этот эффект можно свести к минимуму.
3d-орбитали довольно компактно расположены вокруг ядра. Введение второго электрона на 3d-орбиталь вызывает большее отталкивание, чем если бы следующий электрон перешел на 4s-орбиталь. Между энергиями 3d- и 4s-орбиталей нет очень большого разрыва. Уменьшение отталкивания более чем компенсирует энергию, необходимую для этого.
Таким образом, наиболее энергетически стабильной структурой для Sc + является [Ar] 3d 1 4s 1 .
Изготовление Sc:
Введение последнего электрона для получения нейтрального атома скандия требует такого же обсуждения. В этом случае решение с наименьшей энергией — это решение, в котором последний электрон также переходит на уровень 4s, что дает знакомую структуру [Ar] 3d 1 4s 2 .
В этом случае решение с наименьшей энергией — это решение, в котором последний электрон также переходит на уровень 4s, что дает знакомую структуру [Ar] 3d 1 4s 2 .
Резюме
В каждом из рассмотренных нами случаев 3d-орбитали имеют наименьшую энергию, но по мере добавления электронов отталкивание может вытолкнуть некоторые из них на 4s-уровень с более высокой энергией.
- Если вы создадите атом скандия с нуля, последними электронами, которые войдут в него, будут два 4s-электрона. Это электроны на самом высоком энергетическом уровне, и поэтому логично, что они удалятся первыми, когда скандий образует ионы. И вот что происходит.
- Электроны 4s также являются самыми внешними электронами, и поэтому они в значительной степени определяют радиус атома. Внутри них находятся 3d-орбитали с более низкой энергией, которые будут способствовать экранированию. Противоречия между этими свойствами и порядком заполнения орбит больше нет.

Трудность с этим подходом состоит в том, что вы не можете использовать его для предсказания структур остальных элементов в ряду переходов. На самом деле вам нужно посмотреть на реальную электронную структуру конкретного элемента и его ионов, а затем выяснить, что должно происходить с точки зрения энергетической щели между 3d- и 4s-орбиталями и отталкивания между электронами. .
Обычный способ обучения (основанный на неправильном порядке заполнения 3d- и 4s-орбиталей для переходных металлов) дает метод, который позволяет в большинстве случаев правильно предсказывать электронную структуру атома. Лучший способ взглянуть на это с теоретической точки зрения больше не позволяет вам этого делать. Вы можете обойти это, конечно. Если вы хотите проработать структуру, используйте старый метод. Но помните, что он основан на ложной идее, и не пытайтесь использовать его для чего-либо другого — например, для определения того, какие электроны будут потеряны первыми из переходного элемента.
Думая о других элементах в ряду так же, как мы это делали со скандием, в каждом случае 3d-орбитали займут первый электрон(ы). Затем в какой-то момент отталкивание вытолкнет следующих на 4s-орбиталь. Когда это происходит, зависит от элемента к элементу.
Пример \(\PageIndex{3}\): Ванадий
Ванадий имеет на два электрона больше, чем скандий, и, конечно же, на два протона больше. Подумайте о построении атома ванадия точно так же, как мы построили атом скандия. У нас есть ядро, и теперь мы добавляем электроны. Когда мы добавили 18 электронов, чтобы получить структуру аргона, мы построили V 5 + ион.
Теперь посмотрите, что произойдет, если вы добавите следующие 5 электронов.
| В 5 + | [Ар] | |
| В 4 + | [Ар]3d 1 | |
| В 3+ | [Ар]3d 2 | |
| В 2 + | [Ар]3d 3 | |
| В + | [Ар]3d 4 | |
| В | [Ar]3d 3 4s 2 |
Энергетическая щель между уровнями 3d и 4s увеличилась. В этом случае энергетически невыгодно продвигать любые электроны на уровень 4s до самого конца. В ионах все электроны перешли на 3d-орбитали. Этого нельзя было предсказать, просто взглянув на него.
В этом случае энергетически невыгодно продвигать любые электроны на уровень 4s до самого конца. В ионах все электроны перешли на 3d-орбитали. Этого нельзя было предсказать, просто взглянув на него.
Пример \(\PageIndex{4}\): Хром
Почему электронная структура хрома [Ar]3d 5 4s 1 вместо [Ar]3d 4 4s 2 ?
Решение
Потому что это структура, в которой баланс отталкиваний и размер энергетической щели между 3d- и 4s-орбиталями обеспечивают наименьшую энергию для системы.
Многие учебники химии и учителя пытаются объяснить это, говоря, что полузаполненные орбитали минимизируют отталкивание, но это ошибочный и неполный аргумент. Вы не принимаете во внимание размер энергетической щели между 3d-орбиталями с более низкой энергией и 4s-орбиталью с более высокой энергией.
Две строки непосредственно под хромом в периодической таблице занимают вольфрам. Вольфрам имеет точно такое же количество внешних электронов, как и хром, но его внешняя структура 5d 4 6s 2 , НЕ 5d 5 6s 1 .
В этом случае наиболее энергетически устойчивой является не та структура, в которой орбитали заполнены наполовину. Нельзя делать такие обобщения!
Заключение
- Нынешняя методика обучения студентов отработке электронных структур хороша до тех пор, пока вы понимаете, что это все — способ отработки общих электронных структур, а не порядок заполнения.
- Можно сказать, что для калия и кальция 3d-орбитали имеют более высокую энергию, чем 4s-, и поэтому для этих элементов 4s-уровни заполняются раньше, чем 3d. Это, конечно, совершенно верно!
- Тогда вы можете сказать, что, глядя на структуры следующих 10 элементов переходного ряда, 3d-орбитали постепенно заполняются электронами (с некоторыми осложнениями, такими как хром и медь). Это также верно.
- Что неправильно, так это подразумевать, что уровни 3d в этих 10 элементах имеют более высокие энергии, чем 4s. Это определенно неверно и вызывает проблемы, которые мы обсуждали.

Список литературы
- Доктор Эрик Шерри предоставил мне копии ряда полезных документов и помог мне разобраться в моих идеях по этому поводу. http://ericscerri.blogspot.com/2012/06/trouble-with-using-aufbau-to-find.html
- Р. Н. Келлер: Ошибки учебника, 38: Диаграммы энергетических уровней и внеядерное построение элементов: J. Chem. Educ., 1962, 39 (6), стр. 289, опубликовано в июне 1962 г. .
- WH Eugen Schwarz: Полная история электронных конфигураций переходных элементов: Journal of Chemical Education, Vol. 87 № 4 апрель 2010 г.
Авторы и авторство
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу Содержание
- нет на странице
- Метки

электронных конфигураций
электронных конфигурацийСледующее содержание является сутью лекции по общей химии 26. В этой лекции мы продолжаем обсуждение квантовых чисел и их использования в электронных конфигурациях, а также отношения электронной конфигурации к периодическим свойствам элементов.
Электронная конфигурация
Конфигурации электронов — это сводка того, где электроны находятся вокруг ядра. Как мы узнали ранее, каждый нейтральный атом имеет количество электронов, равное количеству его протонов. Теперь мы поместим эти электроны в такое расположение вокруг ядра, которое укажет на их энергию и форму орбитали, на которой они расположены. Вот краткое изложение типов орбиталей и количества электронов, которые каждая из них может содержать:
Итак, основываясь на том, что мы знаем о квантовых числах, и используя приведенную выше таблицу, вам нужно 2 электрона, чтобы заполнить s-орбиталь, 6 электронов, чтобы заполнить p-орбиталь, 10 электронов, чтобы заполнить d-орбиталь, и 14 электронов, чтобы заполнить f-орбиталь.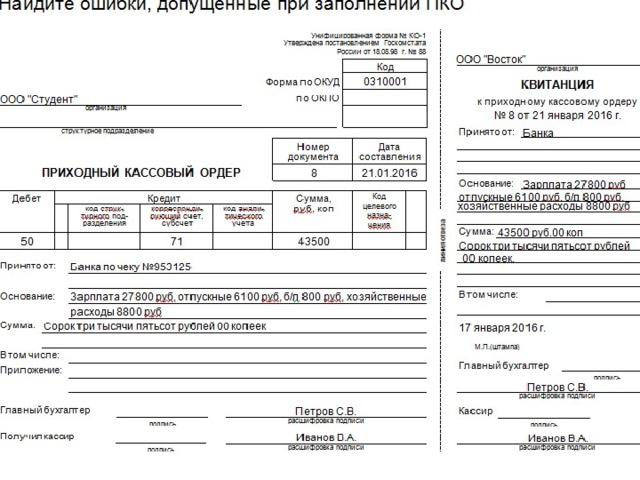 НО то, что мы не обсуждали, так это то, как эти орбитали заполняются… порядок заполнения.
НО то, что мы не обсуждали, так это то, как эти орбитали заполняются… порядок заполнения.
Порядок заполнения
Порядок, в котором электроны размещаются на орбиталях, основан на порядке их энергии. Это называется принципом Ауфбау. Первыми заполняются самые низкоэнергетические орбитали. Как и сами квантовые числа, этот порядок был определен расчетным путем и представлен следующей диаграммой:
или вы можете просто использовать периодическую таблицу:
Как написать электронную конфигурацию
Символы, используемые для записи электронной конфигурации, начинаются с номера оболочки (n), за которым следует тип орбитали, и, наконец, верхний индекс указывает, сколько электронов находится на орбитали.
Например:
Глядя на периодическую таблицу, вы видите, что кислород имеет 8 электронов. Основываясь на приведенном выше порядке заполнения, эти 8 электронов заполнили бы следующий порядок 1s, 2s и затем 2p. Таким образом, электронная конфигурация кислорода будет O 1с 2 2с 2 2п 4 .
Основываясь на приведенном выше порядке заполнения, эти 8 электронов заполнили бы следующий порядок 1s, 2s и затем 2p. Таким образом, электронная конфигурация кислорода будет O 1с 2 2с 2 2п 4 .
Особые случаи
Конфигурации ионов представляют собой частный случай электронной конфигурации, а также в первую очередь демонстрируют причину образования этих ионов.
Если вам нужно записать полную электронную конфигурацию для аниона , то вы просто добавляете дополнительные электроны, и конфигурация просто продолжается.
Например, мы знаем, что кислород всегда образует 2-ионы, когда он образует ион. Это добавит 2 электрона к его нормальной конфигурации, создав новую конфигурацию: O 2- 1s 2 2s 2 2p 6 . Следует отметить, что с 10 электронами электронная конфигурация кислорода теперь точно такая же, как у неона. Мы говорили о том, что ионы образуются, потому что они могут стать более стабильными с присоединением или потерей электронов, чтобы стать похожими на благородные газы, и теперь вы можете увидеть, как они становятся такими же.
Мы говорили о том, что ионы образуются, потому что они могут стать более стабильными с присоединением или потерей электронов, чтобы стать похожими на благородные газы, и теперь вы можете увидеть, как они становятся такими же.
Электронные конфигурации катионов также основаны на количестве электронов, но есть небольшая разница в способе их конфигурации. Сначала вы должны написать их нормальную электронную конфигурацию, а затем, когда вы удаляете электроны, вы должны брать их с самой внешней оболочки. Обратите внимание, что это не всегда тот же способ, которым они были добавлены.
Вот пример того, что я имею в виду:
Iron has 26 electrons so its normal electron configuration would be: Fe 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6
Когда мы создаем ион 3+ для железа, нам нужно сначала взять электроны с самой внешней оболочки, чтобы это была оболочка 4s, а не оболочка 3d: Fe 3+ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5
Еще одно замечание по записи электронных конфигураций: короткий путь. При написании некоторых конфигураций нижних таблиц общая конфигурация может быть довольно длинной. В этих случаях вы можете использовать предыдущий благородный газ для сокращения конфигурации, как показано ниже. Вам просто нужно закончить конфигурацию, откуда выходит благородный газ:
При написании некоторых конфигураций нижних таблиц общая конфигурация может быть довольно длинной. В этих случаях вы можете использовать предыдущий благородный газ для сокращения конфигурации, как показано ниже. Вам просто нужно закончить конфигурацию, откуда выходит благородный газ:
Исключения
Как и в случае с любой другой темой, которую мы рассмотрели на сегодняшний день, существуют исключения из порядка заполнения. Но, исходя из генерируемых электронных конфигураций, эти исключения легко понять.
В блоке d, особенно в группах, содержащих хром и медь, есть исключение в том, как они заполняются.
Вот актуальные конфигурации:
В этих столбцах 4s и 3d
Практика, Практика, Практика
Здесь есть множество викторин по электронным конфигурациям, с которыми вы можете попрактиковаться
Орбитальные диаграммы
Еще один способ представить порядок заполнения атома — использовать орбитальную диаграмму, которую часто называют «маленькими квадратиками»:
Прямоугольники используются для представления орбиталей и для отображения размещенных на них электронов. Порядок заполнения тот же, но, как вы можете видеть сверху, электроны помещаются в ящики по одному, прежде чем заполнить их обоими электронами. Это называется правилом Хунда: «Заполните наполовину, прежде чем заполнить полностью», и снова это правило было установлено на основе расчетов энергии, которые показали, что именно так атомы фактически распределяют свои электроны по орбиталям.
Порядок заполнения тот же, но, как вы можете видеть сверху, электроны помещаются в ящики по одному, прежде чем заполнить их обоими электронами. Это называется правилом Хунда: «Заполните наполовину, прежде чем заполнить полностью», и снова это правило было установлено на основе расчетов энергии, которые показали, что именно так атомы фактически распределяют свои электроны по орбиталям.
Периодические свойства
Одна из действительно интересных особенностей электронных конфигураций — их связь с периодической таблицей. В основном периодическая таблица была построена таким образом, чтобы элементы с одинаковыми электронными конфигурациями были выровнены в одни и те же группы (столбцы).
Периодическая таблица, показывающая последнюю заполненную орбиту для каждого элемента
Периодическая таблица, показанная выше, демонстрирует, как конфигурация каждого элемента была выровнена так, чтобы последняя заполненная орбиталь была такой же, за исключением оболочки. Причина, по которой это было сделано, заключается в том, что конфигурация элемента придает элементу его свойства, а аналогичные конфигурации дают аналогичные свойства.
Причина, по которой это было сделано, заключается в том, что конфигурация элемента придает элементу его свойства, а аналогичные конфигурации дают аналогичные свойства.
Давайте рассмотрим некоторые периодические свойства, на которые напрямую влияет электронная конфигурация:
Атомный размер
Размер атомов увеличивается вниз по таблице Менделеева. Это должно быть интуитивно понятно, поскольку с каждой строкой таблицы вы добавляете оболочку (n). Что не так интуитивно понятно, так это то, почему размер уменьшается слева направо. Но опять же построение электронной конфигурации дает нам ответ. Что вы делаете, просматривая периодическую таблицу? Ответить, добавляя протоны к ядру и добавляя электроны к валентной оболочке элемента. Что не меняется, когда вы пересекаете период? Ответ: электроны внутренней оболочки. Подумайте об этом так: электроны внутренней оболочки являются защитой от притяжения ядра. Так, например, сила притяжения Sulphur будет равна Z Eff = 16 — 10 = +6 |
Электроотрицательность
Электроотрицательность может быть самым важным из периодических свойств, которые вы можете изучить и понять, так как многие другие свойства зависят от его значения. Электроотрицательность — это способность атомов притягивать к себе электроны.
Электроотрицательность — это способность атомов притягивать к себе электроны.
Электроотрицательность обычно выражается по шкале Полинга, и значения были определены экспериментально. В таблице ниже показаны значения шкалы для элементов.
Значения электроотрицательности увеличиваются слева направо и снизу вверх в периодической таблице, за исключением благородных газов. Наиболее электроотрицательным элементом является фтор.
Из этих значений электроотрицательности мы можем вывести модели двух других периодических свойств: энергии ионизации и сродства к электрону.
Энергия ионизации Энергия ионизации — это количество энергии, необходимое для отрыва электрона от атома. Все энергии ионизации являются положительными значениями, потому что все эти удаления (даже для элементов, образующих положительные ионы) требуют ввода энергии. Чем более электроотрицательный элемент, тем выше энергия ионизации. | |
Электронное сродствоЭлектронное сродство элемента — это количество энергии, полученное или высвобожденное при добавлении электрона. Электроотрицательность и сродство к электрону увеличиваются по той же схеме в периодической таблице. Слева направо и снизу вверх. |
Электронные конфигурации
Полные электронные конфигурации
Чтобы записать полную электронную конфигурацию незаряженного атома,
Определить число электронов в атоме по его атомному количество. (См. ниже.)
Добавьте электроны на подуровни в правильном порядке заполнения.
Добавьте по два электрона на каждый s-подуровень, по 6 на каждый p-подуровень. подуровень, 10 на каждый подуровень d и 14 на каждый подуровень f.

Чтобы проверить свою полную электронную конфигурацию, посмотрите, чтобы увидеть соответствует ли положение последнего добавленного электрона положение в периодической таблице.
Прогнозирование порядка заполнения орбиталей
Есть три способа предсказать порядок заполнения орбиталей. Вероятно, наименее надежный метод — запомнить следующий список (даже если он показывает порядок заполнения всех орбиталей, необходимых для описания электронных конфигураций в основном состоянии всех известных элементов).
1с 2с 2п 3с 3п 4с 3д 4п 5с 4д 5п 6s 4f 5d 6p 7s 5f 6d 7p
Вместо того, чтобы полагаться на запоминания, вы можете использовать вспомогательное средство для запоминания, показанное ниже чтобы напомнить вам о правильном порядке заполнения подуровней. Следующее шаги объясняют, как написать его и использовать самостоятельно.
Запишите возможные подуровни для каждого уровня энергии в упорядоченных строках и столбцах, как показано на рисунке ниже.
 Для этого нужно помнить, что на уровне есть один подуровень.
первый главный энергетический уровень, два на втором, три на третьем и т. д.
Каждый главный энергетический уровень имеет s-орбиталь. Второй директор
энергии, и все более высокие энергетические уровни имеют p-подуровень. д
подуровни начинаются на третьем основном энергетическом уровне, подуровни f
старт на четвертом основном энергетическом уровне и т.д.
Для этого нужно помнить, что на уровне есть один подуровень.
первый главный энергетический уровень, два на втором, три на третьем и т. д.
Каждый главный энергетический уровень имеет s-орбиталь. Второй директор
энергии, и все более высокие энергетические уровни имеют p-подуровень. д
подуровни начинаются на третьем основном энергетическом уровне, подуровни f
старт на четвертом основном энергетическом уровне и т.д.Нарисуйте стрелки, как показано ниже.
Начиная с верха стрелку, следуйте за стрелками одну за другой в направлении, которое они указывают, перечисляя подуровней по мере прохождения через них.
Подуровни которые не нужны для описания известных элементов, заключены в скобки ниже.
Мы также можем использовать блок организация периодической таблицы, как показано ниже, чтобы напомнить нам о порядок заполнения подуровней.
 Для этого проходим через
элементы в порядке возрастания атомного номера, перечисляя новые подуровни по мере того, как мы
прийти к ним. Тип подуровня (s, p, d или f)
определяется из блока в
которой находится атомный номер. Число для главного энергетического уровня (для
например, 3 в 3р) определяется из строки, в которой находится элемент
найдено и знание того, что s подуровней начинаются на первом главном
энергетический уровень, p подуровни начинаются на втором основном энергетическом уровне,
подуровни d начинаются на третьем главном энергетическом уровне, а подуровни f
подуровни начинаются
на четвертом основном энергетическом уровне.
Для этого проходим через
элементы в порядке возрастания атомного номера, перечисляя новые подуровни по мере того, как мы
прийти к ним. Тип подуровня (s, p, d или f)
определяется из блока в
которой находится атомный номер. Число для главного энергетического уровня (для
например, 3 в 3р) определяется из строки, в которой находится элемент
найдено и знание того, что s подуровней начинаются на первом главном
энергетический уровень, p подуровни начинаются на втором основном энергетическом уровне,
подуровни d начинаются на третьем главном энергетическом уровне, а подуровни f
подуровни начинаются
на четвертом основном энергетическом уровне.Мы знаем, что первые два электрона, добавленные к атому, переходят на подуровень 1s.
Атомные номера 3 и 4 находятся во второй строке блока s. (ищите их в нижней половине на изображении ниже), что означает, что 3-й и 4-й электрон находится на 2s-подуровне.
Атомные номера от 5 до 10 находятся в первой строке p блок, а подуровни p начинаются на втором энергетическом уровне.
 Следовательно,
электроны с 5-го по 10-й переходят на подуровень 2p.
Следовательно,
электроны с 5-го по 10-й переходят на подуровень 2p.Атомные номера 11 и 12 находятся в третьей строке s блока, поэтому 11-й и 12-й электроны переходят на 3s-подуровень.
Поскольку атомные номера с 13 по 18 находятся в р-блоке, мы знаю, что они переходят на подуровень p. Поскольку подуровни p начинаются на второй главный энергетический уровень и атомные номера с 13 по 18 находятся в второго ряда р-блока электроны с 13-го по 18-й должны перейти в подуровень 3р.
Положение атомных номеров 19 и 20 в четвертой строке блока s и положение атомных номеров с 21 по 30 в первой строке блока d показывают, что подуровень 4s заполняется раньше, чем 3d подуровень.
Перемещение по периодическому table таким образом производит следующий порядок подуровней до 6:
1с 2с 2п 3с 3п 4с 3д 4п 5с 4д 5п 6с
Обратите внимание, что атомные номера от 57 до 70 в периодической таблице ниже в 4f часть стола. Распространенной ошибкой является забывание того, что 4f подуровень заполняется после подуровня 6s и до подуровня 5d подуровень.
 Чтобы сделать общую форму стола более компактной и
удобно отображать, ученые приняли соглашение об удалении
элементы с атомным номером от 57 до 70 и 89через 102 (последнее
часть 5f таблицы) из их естественного положения между s
и d блоки и размещение их в нижней части таблицы. Электроны идут
на подуровень 5f после подуровня 7s и до подуровня 6d
подуровень. Секунда
периодическая таблица
ниже показано, как блоки на
Периодическая таблица соответствовала бы друг другу, если бы внутренние переходные металлы — f
блока — остались в естественном положении.
Чтобы сделать общую форму стола более компактной и
удобно отображать, ученые приняли соглашение об удалении
элементы с атомным номером от 57 до 70 и 89через 102 (последнее
часть 5f таблицы) из их естественного положения между s
и d блоки и размещение их в нижней части таблицы. Электроны идут
на подуровень 5f после подуровня 7s и до подуровня 6d
подуровень. Секунда
периодическая таблица
ниже показано, как блоки на
Периодическая таблица соответствовала бы друг другу, если бы внутренние переходные металлы — f
блока — остались в естественном положении.
Уточнение электронных конфигураций | Chemical Education Xchange
Принцип Ауфбау: правило (n + l)
Мы все видели и используем так называемую диаграмму Ауфбау (рис. 1). Это мнемоника, используемая для запоминания порядка «заполнения» атомных орбиталей при построении электронных конфигураций элементов в основном состоянии. Представление этой диаграммы в значительной степени оторвано от какого-либо физического смысла. Вот что мы говорим нашим студентам: «Запомните схему, научитесь ею пользоваться, и вы гарантированно получите правильный ответ».
Представление этой диаграммы в значительной степени оторвано от какого-либо физического смысла. Вот что мы говорим нашим студентам: «Запомните схему, научитесь ею пользоваться, и вы гарантированно получите правильный ответ».
Рисунок 1. Диаграмма Ауфбау: атомные орбитали заполняются, начиная с 1s и продолжая, начиная с верхнего левого угла, в порядке, указанном стрелками.
Есть ли способ связать эту диаграмму с ее физическим смыслом? Да! Это цель этой статьи.
Как вообще была построена эта диаграмма? Оказывается, это представление метода предсказания «порядка заполнения», называемого правилом Маделунга, которое также называют правилом (n + l). «n» и «l» в правиле (n + l) — это квантовые числа, используемые для определения состояния данной электронной орбитали в атоме. n является главным квантовым числом и связано с размером орбитали. l является квантовым числом углового момента и связано с формой орбитали.
Вот как работает правило (n + l). (Относительные) энергии орбиталей можно предсказать как сумму n + l для каждой орбитали в соответствии со следующими правилами:
а. Орбитали заполняются в порядке возрастания (n + l), что представляет собой относительную энергию.
б. Если две орбитали имеют одинаковое значение (n + l), они заполняются в порядке возрастания n.
Диаграмма на рисунке 1 является результатом этих правил.
Рисунок 2 представляет собой вариант диаграммы, которая отображает зависимость от (n + l) для каждой орбитали, где E представляет собой относительную энергию орбиталей. Орбитали заполняются в соответствии со значениями E для каждой орбитали: E=1 для 1 с, E=2 для 2 с, E=3 для 2p и 3 с и так далее. Согласно приведенному выше правилу (b), когда две орбитали имеют одинаковое E, например, E=3 для 2p и 3s, первой заполняется орбиталь с более низким n (2p).
Рис. 2. Диаграмма Ауфбау, иллюстрирующая правило (n+1).
Правило (n + l) — удивительно умный и полезный инструмент. Он правильно предсказывает порядок орбитальных энергий через элемент 20 (кальций). Кроме того, он правильно предсказывает множество электронных конфигураций. И здесь мы подходим к очень важному моменту: предсказание относительных энергий каждой орбитали — это не то же самое, что предсказание правильных конфигураций электронов. Подробнее об этом позже.
Почему работает правило (n + l)? Это не магия, и сейчас мы обсудим связь между правилом и его физическим смыслом. Чтобы понять связь, нам нужно начать с того, как квантовые числа n и l связаны с энергией орбитали. Для демонстрации мы будем использовать 3D-модели (на самом деле 2D-изображения 3D-моделей) атомных орбиталей. [ Простите, что разочаровал тех, кто хочет глубоко погрузиться в квантово-механические расчеты. Эти модели являются визуальным представлением результатов этих вычислений. ]
На рисунке 3 мы видим представление орбиталей, занятых электронами в основном состоянии элемента криптона (для ясности орбитали отделены друг от друга). Обратите внимание, что по мере увеличения квантового числа n (от 1 до 4 в криптоне) увеличивается и общий размер орбитали.
Обратите внимание, что по мере увеличения квантового числа n (от 1 до 4 в криптоне) увеличивается и общий размер орбитали.
Рис. 3. Электронная конфигурация криптона. (Создано с помощью лаборатории электронной конфигурации Atomsmith Classroom 1 )
Как размер орбитали связан с ее энергией? Напомним, что потенциальная энергия притяжения между протонами и электронами, имеющими противоположные заряды, зависит от расстояния между ними: чем ближе электрон подойдет к протонам в ядре, тем ниже будет его энергия. Сравните размеры 1s (n = 1) и 4s (n = 4) орбиталей (рис. 3). Поскольку 1s-орбиталь меньше, среднее расстояние электрона до ядра будет меньше, чем у электронов на 4s-орбитали. Вот такая связь — чем выше n, тем выше энергия орбитали.
А как насчет l в правиле (n + l)? Как упоминалось выше, l, квантовое число углового момента, определяет форму орбитали. На всех орбиталях, для которых n > 1, есть области, называемые узлами, в которых крайне маловероятно найти электрон. Узлы бывают двух типов: радиальные и плоскостные (или угловые). На рисунке 4 показан радиальный узел на 2s-орбитали (l = 0) и плоский узел на 2p-орбитали (l = 1). Обратите внимание, что радиальный узел (рис. 4, в центре) не пересекает ядро, в то время как плоские узлы (рис. 4, справа) это делают. s орбиталей (для которых l = 0) содержат только радиальные узлы. Все остальные орбитали (p, d, f и т. д., для которых l > 0) содержат как радиальные, так и плоские узлы.
Узлы бывают двух типов: радиальные и плоскостные (или угловые). На рисунке 4 показан радиальный узел на 2s-орбитали (l = 0) и плоский узел на 2p-орбитали (l = 1). Обратите внимание, что радиальный узел (рис. 4, в центре) не пересекает ядро, в то время как плоские узлы (рис. 4, справа) это делают. s орбиталей (для которых l = 0) содержат только радиальные узлы. Все остальные орбитали (p, d, f и т. д., для которых l > 0) содержат как радиальные, так и плоские узлы.
Рис. 4. Слева: 2s- и 2p-орбитали перекрываются. Центр: радиальный узел (l = 0) на 2s-орбитали (зеленый кружок). Справа: плоский узел (l = 1) на 2p-орбитали (зеленая линия). Орбитали 2s и 2p (в центре и справа) были «нарезаны» в орбитальной лаборатории Atomsmith.
Общее количество узлов (радиальных + плоских) на орбитали равно (n – 1). Из них l узлов плоские.
Как количество плоских узлов влияет на энергию орбитали? Посмотрите еще раз на радиальный и плоский узлы на рисунке 4: плоский узел пересекает ядро, где находятся положительно заряженные протоны. Радиальные узлы не пересекают ядро.
Радиальные узлы не пересекают ядро.
Если узел представляет собой область, где маловероятно обнаружение электрона, то электроны на орбиталях с плоскими узлами, скорее всего, будут находиться дальше от ядра (в среднем). Как мы обсуждали ранее, большие расстояния от ядра означают более высокую энергию. Таким образом, чем выше значение l, тем больше плоских узлов у орбитали и тем выше энергия орбиты.
Таким образом, правило (n + l) позволяет учесть два основных фактора, влияющих на относительную энергию атомных орбиталей: размер орбитали (зависит от n) и количество плоских узлов (= l). В случаях, когда (n + l) одинаково для двух орбиталей (например, 2p и 3s), правило (n + l) говорит, что орбиталь с более низким n имеет более низкую энергию. Другими словами, размер орбитали оказывает большее влияние на орбитальную энергию, чем количество плоских узлов.
Как и все модели, нажмите Aufbau (n + l) достаточно далеко, и это не удастся.
Правило (n + l) является моделью. И, как мы говорим нашим студентам, все модели имеют пределы. Правило (n + l) хорошо работает до Z = 20, кальций (Z — атомный номер). Что значит «хорошо работает»? Он успешно предсказывает две вещи:
И, как мы говорим нашим студентам, все модели имеют пределы. Правило (n + l) хорошо работает до Z = 20, кальций (Z — атомный номер). Что значит «хорошо работает»? Он успешно предсказывает две вещи:
- относительные энергии орбиталей
- порядок заполнения орбиталей
Возможно, не очевидно, что эти две вещи разные. Но они есть, и различия начинают иметь значение при Z = 21, скандий — начало переходных металлов.
Для Z = 20, кальций, правило (n + l) гласит:
- 4s-орбиталь имеет более низкую энергию, чем 3d-орбиталь
- 4s-орбиталь занята, а 3d-орбитали — нет (1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 900).
Оба варианта верны!
Для Z = 21, скандий, правило (n + l) гласит:
- 4s-орбиталь имеет более низкую энергию, чем 3d-орбиталь
- занята 4s-орбиталь и занята одна 3d-орбиталь (1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 ).

Здесь правило (n + l) впервые не работает. № 2 (профессия) правильный, а № 1 неправильный. Для переходных металлов энергия 3d ниже, чем 4s! На рис. 5 показана зависимость между орбитальной энергией и атомным номером (Z). Обратите внимание, что кривые орбитальной энергии 4s и 3d пересекаются при Z = 21.
Рис. 5. Зависимость между орбитальной электронной энергией и атомным номером (Z). Ванкикенборн Л.Г., Пьерлут К. и Девогель Д. Переходные металлы и принцип Ауфбау. Дж. Хим. Эд., 1994, 71(6) 469- 471.
Однако, и это важный момент: хотя правило (n + l) неправильно определяет орбитальную энергию, оно по-прежнему дает правильную конфигурацию электронов (орбитальные заселенности). !
Как возможно, что у переходных металлов 3d-орбитали имеют меньшую энергию, но не заняты преимущественно?
Короткий ответ заключается в том, что орбитальные энергии не являются единственным важным фактором, определяющим, как заняты орбитали. Длинный ответ? Это сложно — очень сложно.
Длинный ответ? Это сложно — очень сложно.
Проф. д-р В.Х. Ойген Шварц, химик-теоретик из Зигенского университета в Германии, опубликовал ряд статей на эту тему. Его результаты явно выходят за рамки любого вводного курса химии, но мы надеемся дать вам представление о том, как другие факторы, помимо орбитальной энергии, могут влиять на заполнение атомных орбиталей в электронной конфигурации.
Шварц объясняет пять факторов, влияющих на электронную конфигурацию переходных металлов: 2
- д-орбитальный коллапс
- d против отталкивания электронов s
- s Дестабилизация Ридберга
- конфигураций и состояний в свободных и связанных атомах
- релятивистская спин-орбитальная связь
Мы рассмотрим исключительно второй фактор: d против s отталкивания электронов.
Рассмотрим титан (Z = 22). Его электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 , что правильно предсказывает правило (n + l). Если бы конфигурация электрона зависела исключительно от орбитальной энергии, мы могли бы ожидать: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s на орбите.
Если бы конфигурация электрона зависела исключительно от орбитальной энергии, мы могли бы ожидать: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s на орбите.
Почему последние четыре электрона преимущественно не занимают 3d-орбитали, энергия которых ниже, чем 4s-орбитали?
Рассмотрим рисунок 6a, где мы видим модели 4s и 3d орбиталей, разделенные в лаборатории электронной конфигурации Atomsmith Classroom. Если бы электронная конфигурация титана была 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 , четыре из пяти 3d-орбиталей будут содержать по одному электрону каждая. И орбиталь 4s будет незанятой.
На рисунке 6b орбитали 3d и 4s наложены друг на друга вокруг ядра. Так же, как протоны и электроны притягиваются друг к другу из-за их противоположных зарядов, электроны отталкиваются друг от друга, потому что они имеют одинаковый заряд. Это отталкивание приводит к более высокой энергии — вещи просто становятся тесными.
Что могут сделать электроны, чтобы свести к минимуму это отталкивание? Обратите внимание, что 4s-орбиталь больше, чем 3d-орбитали. Если два из этих электронов попадут на 4s-орбиталь вместо 3d-орбитали, у них будет больше места для распространения, чтобы минимизировать отталкивание. Это лежит в основе «отталкивания электронов d против s» Шварца.
Рисунок 6а. 4s и 3d орбитали разделены.
Рис. 6б. 4s и 3d орбитали перекрываются.
Как вы можете это использовать?
Подведем итог тому, что мы уже обсуждали:
До Z = 20 (кальций) правило (n + l) (и диаграмма Ауфбау) правильно предсказывает:
- Орбитальные энергетические уровни
Порядок заполнения орбиталей
- Физический смысл правила (n + l) (и его способность делать эти предсказания) связан с размером (n) и формой (l) данной орбитали.
Для Z > 20 (начиная с переходных металлов):
- Правило (n + l) не может правильно предсказать орбитальные уровни энергии.

- Даже когда мы знаем орбитальные энергии, этого знания недостаточно, чтобы предсказать порядок заполнения. Необходимо учитывать и другие факторы, такие как «отталкивание электронов d против s» (скопление). (Шварц обсуждает еще четыре из них).
- Хотя его физического смысла уже недостаточно, правило (n + l) по-прежнему правильно предсказывает порядок заполнения. За исключением случаев, когда это не так, и мы вызываем «исключения».
Первый вывод, который следует сделать из этого, заключается в том, что правило (n + l) является моделью и что оно работает… до тех пор, пока не перестанет работать. Если вы решите преподавать его как модель и связать с каким-то физическим смыслом, обсуждавшимся выше, это станет отличным примером того, как модели могут быть как полезными, так и ошибочными.
«История», изложенная выше, может принести вашим ученикам гораздо больше удовольствия, чем «Запомните схему, научитесь ее использовать, и вы гарантированно получите правильный ответ». Но это сложная история, чтобы рассказать ее, просто помахав рукой. Вам нужна модель, чтобы сказать это, и модели нужны следующие функции:
Но это сложная история, чтобы рассказать ее, просто помахав рукой. Вам нужна модель, чтобы сказать это, и модели нужны следующие функции:
- Учащиеся должны понимать основы кулоновских взаимодействий: энергия противоположных зарядов ниже, когда они расположены близко друг к другу; отталкивание одинаковых зарядов приводит к увеличению энергии.
- Представления атомных орбиталей, которые физически точны как по размеру (n), так и по форме (l)
- 3D лучше, чем 2D
- Орбитали должны быть сепарабельными и накладывающимися
- Желательна интерактивность
Вы не сможете рассказать эту историю без возможности показать своим ученикам относительные размеры и формы (т. е. узлы) орбиталей (№ 2). Изображения орбиталей в учебнике могут подойти многим учащимся; но всем учащимся будет полезна возможность интерактивно наблюдать (№ 5) за размерами и формами в 3D (№ 3), а также разделять и накладывать их друг на друга (№ 4; рис. 6a и 6b), чтобы они могли понять, как переполнен атом на самом деле.
Принцип Ауфбау, впервые представленный Нильсом Бором в 1920 году, и его реализация в виде правила (n + l) — очень полезная абстракция. В связи с его физическим значением он может стать частью мощной ментальной модели, которую учащиеся могут использовать для построения (и объяснения) своего понимания структуры атома. Этот тип связи демонстрирует реальную перспективу трехмерных представлений частиц атомной и молекулярной структуры и явлений. Таких историй будет рассказано еще много.
Примечание автора. Идея этой статьи возникла в результате дискуссии между автором и Томом Кунцлеманом. Том описывает это взаимодействие в записи блога «Беседы, признания, путаница (и, надеюсь, некоторая ясность) об электронных конфигурациях».
Ссылки:
- Atomsmith Classroom, Bitwixt Software Systems, www.bitwixt.com(внешняя ссылка). Доступно для компьютеров Mac и Windows, а также в виде онлайн-приложения HTML5 для браузеров на всех платформах.
- Schwarz, W.H.E.
 The Full Story of the Electron Configurations of the Transition Elements, J. Chem. образования, 2010, 87, 444 – 448.
The Full Story of the Electron Configurations of the Transition Elements, J. Chem. образования, 2010, 87, 444 – 448.
Правила заполнения электронами орбиталей – принцип Ауфбау
Электронная конфигурация молекулы относится к диспергированию электронов на отдельных молекулярных орбиталях. Очень важно понять молекулу. Электронная конфигурация молекулы или молекулярного иона может быть использована для расчета числа электронов на его связывающих и разрыхляющих молекулярных орбиталях. Стабильность атома можно предсказать, используя электронную конфигурацию. Каждая оболочка имеет фиксированное количество электронов. Он определяется по простой формуле, где максимальное число электронов для n-й оболочки равно 2n 2 .
Как только атом занимает все свои орбитали, он становится наиболее стабильным и, следовательно, нереакционноспособным. Кроме того, наиболее стабильная электронная конфигурация обладает полным энергетическим состоянием. Благородные газы нелегко объединяются с другими молекулами, поскольку эти орбитальные конфигурации являются важными особенностями. В отличие от многих других химических концепций, Aufbau — это немецкое слово, которое означает «наращивание». Это не имя ученого. Этот принцип в первую очередь связан с заполнением электронами орбитали при составлении электронной конфигурации.
В отличие от многих других химических концепций, Aufbau — это немецкое слово, которое означает «наращивание». Это не имя ученого. Этот принцип в первую очередь связан с заполнением электронами орбитали при составлении электронной конфигурации.
Присоединяйтесь к программе регулярных занятий Infinity Learn!
Загрузите БЕСПЛАТНО PDF-файлы, решенные вопросы, работы за предыдущий год, викторины и головоломки!
+91
Проверьте код OTP (обязательно)
класс
— Класс 6CLASS 7CLASS 9CLASS 9CLASS 10CLASS 11CLASS 12
КУРС
— CBSEIIT-JEENEET
ШКОЛА/Колледж название
SRI CHAITANEA?
НетДа
Я согласен с условиями и политикой конфиденциальности.
Обзор Электроны намного меньше протонов и нейтронов и весят более чем в 1800 раз меньше, чем протоны и нейтроны. Электронная конфигурация атома — это орбитальное описание расположения электронов в типичном атоме. Химики могут предсказать свойства атома, такие как стабильность, температура кипения и проводимость, используя электронную конфигурацию и физические принципы. Это метод или распределение электронов на орбиталях атома. Атом состоит из субатомных частиц, таких как электроны, протоны и нейтроны, причем для электронного устройства учитывается только количество электронов. Электроны подаются таким образом, что достигается высокая постоянная конфигурация.
Это метод или распределение электронов на орбиталях атома. Атом состоит из субатомных частиц, таких как электроны, протоны и нейтроны, причем для электронного устройства учитывается только количество электронов. Электроны подаются таким образом, что достигается высокая постоянная конфигурация.
Квантовым свойством электронов является спин электрона. Это пример углового момента. Значение модуля этого углового момента фиксировано. Спин, как заряд и масса покоя, является фундаментальной, неизменной характеристикой электрона. Спиновый угловой момент, связанный со спином электрона, отличается от орбитального углового момента, связанного с электронами, движущимися вокруг ядра.
Правила заполнения электронами Принцип Ауфбау, правило Хунда и принцип запрета Паули — это набор общих правил, используемых для определения электронной конфигурации атомных видов. Прежде чем продолжить, важно понять, что каждая орбиталь может быть занята двумя электронами с противоположными спинами (которые будут обсуждаться позже).
В общем, принцип Ауфбау регулирует заполнение электронами атомных орбиталей атома в его основном состоянии. В нем говорится, что электроны заполняются атомными орбиталями в последовательности увеличения орбитальных энергетических уровней. Мы можем сформулировать принцип Ауфбау как доступные атомные орбитали с самыми низкими энергетическими уровнями, занятыми первыми, а затем с более высокими энергетическими уровнями.
Термин «Aufbau» имеет немецкие корни и может быть примерно переведен как «сооружение» или «наращивание». На приведенном ниже рисунке показан порядок заполнения атомных орбиталей. Первичное квантовое число обозначается буквой «n», а азимутальное квантовое число обозначается буквой «l».
Принцип Ауфбау можно использовать для объяснения размещения электронов в атоме и связанных с ними энергетических уровней. Например, углерод имеет 6 электронов, а его электрическая конфигурация равна 1s 2 9. 0269 2s 2 2p 2 .
0269 2s 2 2p 2 .
Существуют многочисленные отклонения, такие как электронная конфигурация хрома. Наполовину заполненная подоболочка увеличивает стабильность орбиты за счет отталкивания электронов. Точно так же полная подоболочка повышает стабильность атома. Это связано с тем, что многие атомные электронные структуры, такие как медь, не придерживаются принципа Ауфбау.
Принципиальный порядок Aufbau Этот порядок занятия обычно отражает повышение уровня энергии орбиталей. В результате электроны занимают орбитали таким образом, что энергия остается минимальной. То есть, если орбитали с более низкой энергией, от 1s до 6p, уже полностью заняты, подоболочки 7s, 5f, 6d и 7p не будут заполнены электронами. Также стоит отметить, что, несмотря на то, что энергия 3d-орбитали ниже, чем у 4s-орбитали, электроны сначала занимают 4s-орбиталь, а затем 3d-орбиталь. Это открытие можно объяснить тем фактом, что 3d-электроны с большей вероятностью находятся вблизи ядра и поэтому сильнее отталкиваются друг от друга.
- В соответствии с принципом Ауфбау электроны сначала занимают орбитали с наименьшей энергией. Это означает, что электроны выходят на орбитали с более высокой энергией только после того, как орбитали с более низкой энергией полностью заполнены.
- Правило (n+1) можно использовать для определения последовательности, в которой растет энергия орбиталей, где сумма первичного и азимутального квантовых чисел определяет энергетический уровень орбитали.
- Более низкие (n+l) значения указывают на более низкую орбитальную энергию. Если две орбитали имеют эквивалентные (n + l) значения, говорят, что орбиталь с меньшим значением n имеет более низкую энергию.
- Каждая орбиталь заполнена электронами в следующем порядке: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p , и так далее.
Принцип Ауфбау устанавливает некоторые фундаментальные критерии заполнения орбиталей в атоме. Атом в основном состоянии имеет наименьшее количество энергии и является наиболее стабильным. Принцип Ауфбау регулирует заполнение орбиталей в основном состоянии атома. Этот принцип также основан на принципе запрета Паули, правиле максимальной множественности Хунда и орбитальных относительных энергиях. В соответствии с этим принципом электроны вводятся на различные орбитали в порядке возрастания энергии. Электроны сначала входят на доступную им орбиталь с наименьшей энергией, а затем переходят на орбитали с более высокой энергией только после того, как орбитали с более низкой энергией будут заполнены.
Атом в основном состоянии имеет наименьшее количество энергии и является наиболее стабильным. Принцип Ауфбау регулирует заполнение орбиталей в основном состоянии атома. Этот принцип также основан на принципе запрета Паули, правиле максимальной множественности Хунда и орбитальных относительных энергиях. В соответствии с этим принципом электроны вводятся на различные орбитали в порядке возрастания энергии. Электроны сначала входят на доступную им орбиталь с наименьшей энергией, а затем переходят на орбитали с более высокой энергией только после того, как орбитали с более низкой энергией будут заполнены.
Квантово-механическая модель определяет определенные места в пространстве вокруг ядра, где вероятность обнаружения ядра наибольшая. Такие области описываются математически и известны как орбитальные волновые функции или просто орбитали. Атом имеет огромное количество орбиталей. Форма, размер и направление этих орбиталей количественно отличают их друг от друга. Меньшая орбиталь предполагает, что электрон с большей вероятностью находится вблизи ядра. В результате принцип Ауфбау устанавливает некоторые важные правила заполнения орбиталей в атоме.
В результате принцип Ауфбау устанавливает некоторые важные правила заполнения орбиталей в атоме.
Информация о принципе Ауфбау из различных статей по химии доступна здесь. Принцип Ауфбау является важной темой в химии. Студенты, которые хотят преуспеть в химии, должны хорошо знать об этом, чтобы получить глубокие знания об этом, чтобы хорошо сдать экзамены. Здесь представлены концепции и краткие пояснения, чтобы помочь учащимся эффективно понять соответствующую тему.
Получите самые важные вопросы по Физика, Химия, Математика, и Биология.
Преодолейте NEET с помощью программы обучения, ориентированной на результат, от Infinity Learn.
Часто задаваемые вопросыВерен ли принцип Ауфбау?
Принцип Ауфбау используется для предсказания электронных конфигураций атомов и, как следствие, для объяснения архитектуры периодической таблицы и того, как электроны упорядочены от низких до высоких энергетических уровней.

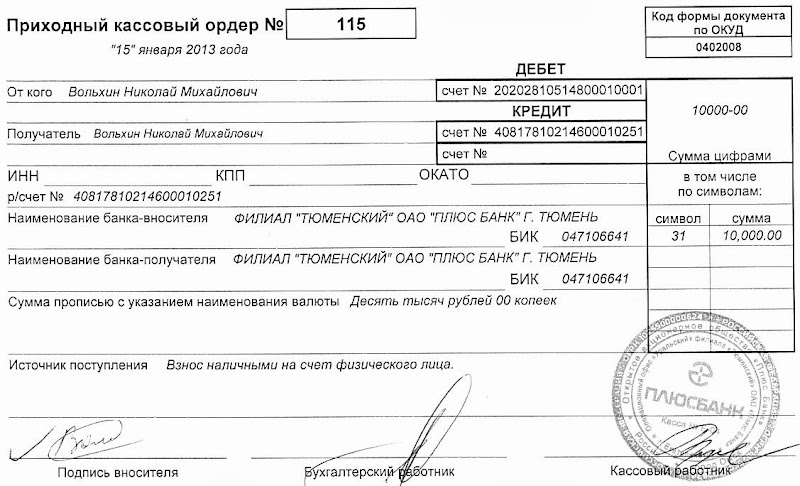 Она должна соответствовать дате в журнале. Принимать наличные по кассовым ордерам можно лишь в тот день, когда их составили
Она должна соответствовать дате в журнале. Принимать наличные по кассовым ордерам можно лишь в тот день, когда их составили Этот реквизит не заполняйте, если составляете приходный кассовый ордер на общую сумму операций, которые провело предприятие. Например, в случае получения наличности в банке (п. 32 Положения, утвержденного постановлением НБУ от 29.12.2017 № 148; письмо НБУ от 14.09.2016 № 50-0004/77077)
Этот реквизит не заполняйте, если составляете приходный кассовый ордер на общую сумму операций, которые провело предприятие. Например, в случае получения наличности в банке (п. 32 Положения, утвержденного постановлением НБУ от 29.12.2017 № 148; письмо НБУ от 14.09.2016 № 50-0004/77077)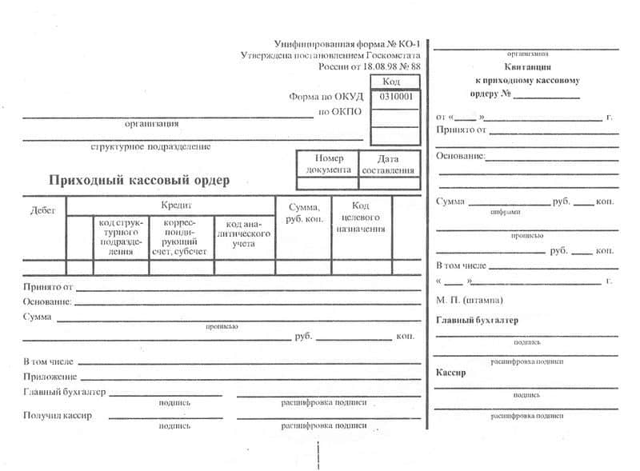 25 Положения № 148). Подписывайте только собственноручно, никаких факсимиле (ВИР, категория 109.15)
25 Положения № 148). Подписывайте только собственноручно, никаких факсимиле (ВИР, категория 109.15)



 В строке «Дебет» отражается счет 50 «Касса», возможно использование валютной кассы или аналитического субсчета, прописанного в учетной политике предприятия. Для заполнения строки «Кредит» необходимо знать источник поступления средств.
В строке «Дебет» отражается счет 50 «Касса», возможно использование валютной кассы или аналитического субсчета, прописанного в учетной политике предприятия. Для заполнения строки «Кредит» необходимо знать источник поступления средств.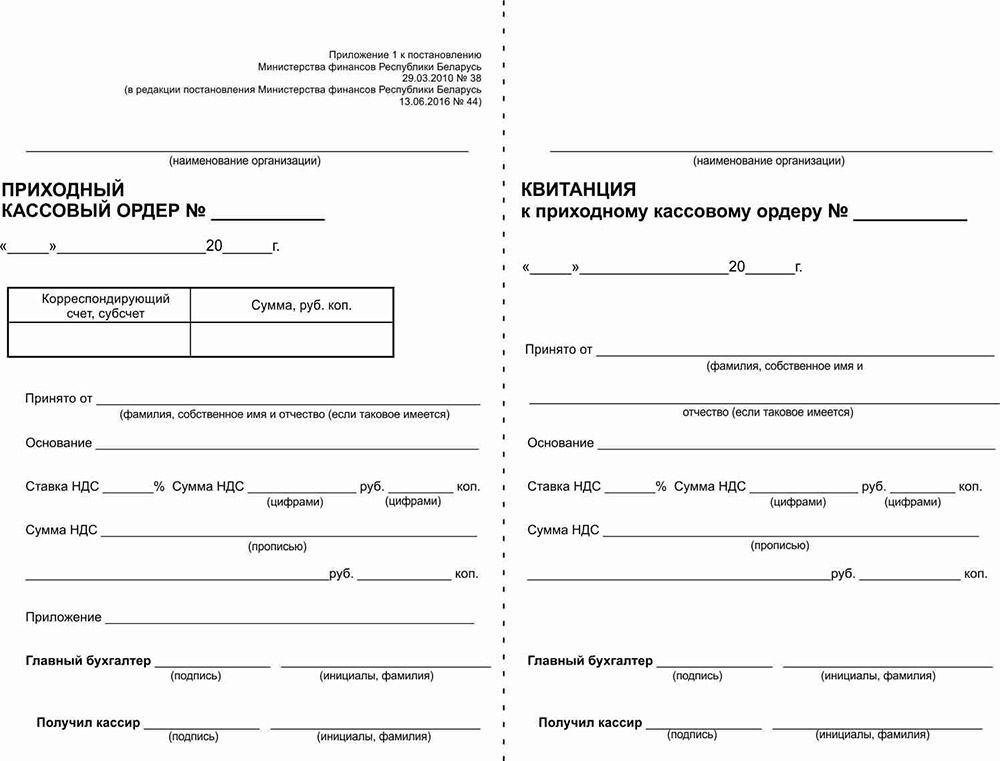


 Если бы я хотел отправиться в путешествие, мне нужно было бы взять с собой принтер для этикеток, продукты и упаковочные материалы. Я оказался в отпуске, постоянно проверяя новые заказы и отправляя товар из багажника своей машины.
Если бы я хотел отправиться в путешествие, мне нужно было бы взять с собой принтер для этикеток, продукты и упаковочные материалы. Я оказался в отпуске, постоянно проверяя новые заказы и отправляя товар из багажника своей машины. 


 Когда вы пересекаете период и увеличиваете количество протонов в ядре, вы увеличиваете его притяжение, но поскольку вы только добавляете электроны в новую оболочку, экран не увеличивается, а остается неизменным на всем протяжении. Это означает, что притяжение электронов, добавляемых к валентной оболочке, неуклонно увеличивается на всем протяжении. Что произойдет, если вы потянете электроны сильнее? Ну, они приближаются к ядру и размер атома уменьшается. Эффект притяжения ядра на электроны, добавляемые за период, называется эффективным зарядом ядра и рассчитывается как Z Eff = #протоны — Ядро # Электроны.
Когда вы пересекаете период и увеличиваете количество протонов в ядре, вы увеличиваете его притяжение, но поскольку вы только добавляете электроны в новую оболочку, экран не увеличивается, а остается неизменным на всем протяжении. Это означает, что притяжение электронов, добавляемых к валентной оболочке, неуклонно увеличивается на всем протяжении. Что произойдет, если вы потянете электроны сильнее? Ну, они приближаются к ядру и размер атома уменьшается. Эффект притяжения ядра на электроны, добавляемые за период, называется эффективным зарядом ядра и рассчитывается как Z Eff = #протоны — Ядро # Электроны. 

 Для этого нужно помнить, что на уровне есть один подуровень.
первый главный энергетический уровень, два на втором, три на третьем и т. д.
Каждый главный энергетический уровень имеет s-орбиталь. Второй директор
энергии, и все более высокие энергетические уровни имеют p-подуровень. д
подуровни начинаются на третьем основном энергетическом уровне, подуровни f
старт на четвертом основном энергетическом уровне и т.д.
Для этого нужно помнить, что на уровне есть один подуровень.
первый главный энергетический уровень, два на втором, три на третьем и т. д.
Каждый главный энергетический уровень имеет s-орбиталь. Второй директор
энергии, и все более высокие энергетические уровни имеют p-подуровень. д
подуровни начинаются на третьем основном энергетическом уровне, подуровни f
старт на четвертом основном энергетическом уровне и т.д. Для этого проходим через
элементы в порядке возрастания атомного номера, перечисляя новые подуровни по мере того, как мы
прийти к ним. Тип подуровня (s, p, d или f)
определяется из блока в
которой находится атомный номер. Число для главного энергетического уровня (для
например, 3 в 3р) определяется из строки, в которой находится элемент
найдено и знание того, что s подуровней начинаются на первом главном
энергетический уровень, p подуровни начинаются на втором основном энергетическом уровне,
подуровни d начинаются на третьем главном энергетическом уровне, а подуровни f
подуровни начинаются
на четвертом основном энергетическом уровне.
Для этого проходим через
элементы в порядке возрастания атомного номера, перечисляя новые подуровни по мере того, как мы
прийти к ним. Тип подуровня (s, p, d или f)
определяется из блока в
которой находится атомный номер. Число для главного энергетического уровня (для
например, 3 в 3р) определяется из строки, в которой находится элемент
найдено и знание того, что s подуровней начинаются на первом главном
энергетический уровень, p подуровни начинаются на втором основном энергетическом уровне,
подуровни d начинаются на третьем главном энергетическом уровне, а подуровни f
подуровни начинаются
на четвертом основном энергетическом уровне.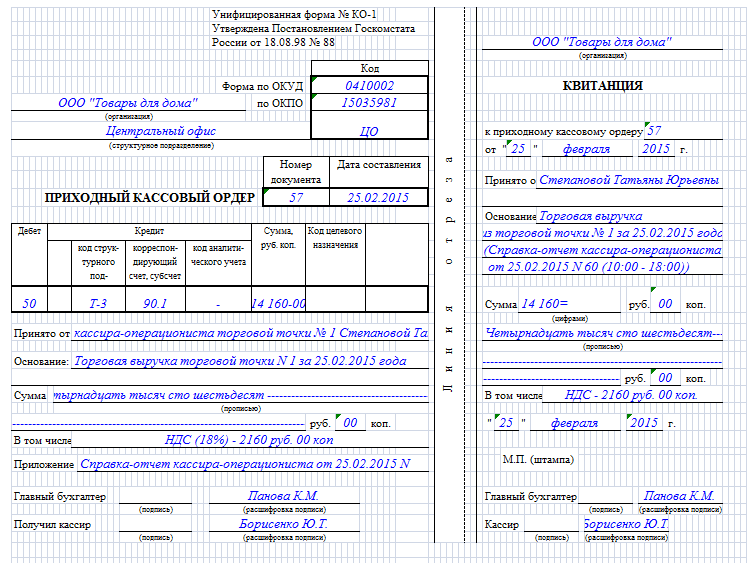 Следовательно,
электроны с 5-го по 10-й переходят на подуровень 2p.
Следовательно,
электроны с 5-го по 10-й переходят на подуровень 2p. Чтобы сделать общую форму стола более компактной и
удобно отображать, ученые приняли соглашение об удалении
элементы с атомным номером от 57 до 70 и 89через 102 (последнее
часть 5f таблицы) из их естественного положения между s
и d блоки и размещение их в нижней части таблицы. Электроны идут
на подуровень 5f после подуровня 7s и до подуровня 6d
подуровень. Секунда
периодическая таблица
ниже показано, как блоки на
Периодическая таблица соответствовала бы друг другу, если бы внутренние переходные металлы — f
блока — остались в естественном положении.
Чтобы сделать общую форму стола более компактной и
удобно отображать, ученые приняли соглашение об удалении
элементы с атомным номером от 57 до 70 и 89через 102 (последнее
часть 5f таблицы) из их естественного положения между s
и d блоки и размещение их в нижней части таблицы. Электроны идут
на подуровень 5f после подуровня 7s и до подуровня 6d
подуровень. Секунда
периодическая таблица
ниже показано, как блоки на
Периодическая таблица соответствовала бы друг другу, если бы внутренние переходные металлы — f
блока — остались в естественном положении.